
| A. | 1 mol OD-离子含有的质子、中子数均为10NA | |
| B. | 标准状况下,4.48 L己烷含有的分子数为0.2NA | |
| C. | 标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.2NA | |
| D. | 丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA |
分析 A.1个OD-离子含有的质子、中子数均为9;
B.标况下,己烷是液体,气体摩尔体积对其不适用;
C.标况下n(NO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,二氧化氮和水反应方程式为3NO2+H2O=2HNO3+NO,该反应中作氧化剂和还原剂的二氧化氮物质的量之比为1:2,所以参加反应的二氧化氮有0.1mol作氧化剂;
D.丙烯和环丙烷互为同分异构体,n(C3H6)=$\frac{42g}{42g/mol}$=1mol,每个分子中含有6个H原子,则氢原子的物质的量是6mol.
解答 解:A.1个OD-离子含有的质子、中子数均为9,则1 mol OD-离子含有的质子、中子数均为9NA,故A错误;
B.标况下,己烷是液体,气体摩尔体积对其不适用,所以无法计算己烷的物质的量,导致无法计算己烷分子个数,故B错误;
C.标况下n(NO2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,二氧化氮和水反应方程式为3NO2+H2O=2HNO3+NO,该反应中作氧化剂和还原剂的二氧化氮物质的量之比为1:2,所以参加反应的二氧化氮有0.1mol作氧化剂,即标准状况下,6.72LNO2与水反应消耗的氧化剂分子数为0.1NA,故C错误;
D.丙烯和环丙烷互为同分异构体,n(C3H6)=$\frac{42g}{42g/mol}$=1mol,每个分子中含有6个H原子,则氢原子的物质的量是6mol,即氢原子的个数为6NA,故D正确;
故选D.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,明确物质结构特点、分子构成、氧化还原反应原理是解本题关键,注意气体摩尔体积适用范围和适用条件,易错选项是AD.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 饱和烃就是烷烃 | |
| B. | 随着碳原子数的递增,烷烃的熔沸点逐渐降低 | |
| C. | 取代反应中可能有单质生成 | |
| D. | 任何烷烃分子都不可能为平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中性溶液AG=0 | |
| B. | 常温下0.1mol/L氢氧化钠溶液的AG=12 | |
| C. | 酸性溶液AG<0 | |
| D. | 常温下0.1mol/L的盐酸溶液的AG=13 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 37g37Cl2中含有20 NA个质子 | B. | 18 g 2H216O中含有10 NA个电子 | ||
| C. | 26Mg2+中含有10 NA个电子 | D. | 1mol18O中含有10 NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c (CH3COO-)>c(H+)>c(OH-) | |
| B. | 等体积等物质的量浓度NaF 溶液与HF混合:c(Na+)=c(F-)+c(HF) | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到pH=5的混合溶液:c(Na+)=c(NO3-) | |
| D. | c(NH4+)相等的(NH4)2CO3、(NH4)2SO4、(NH4)2Fe(SO4)2三份溶液,其c依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ⑥ | ⑦ | ||||||
| 三 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 四 | ② | ④ | ⑨ |
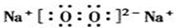 ;
;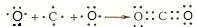 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com