
分析 (1)有颜色的离子不用做实验就能判断是否存在;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+;能和NaOH溶液反应的离子是Mg2+;
(3)根据分析确定一定存在的离子,然后结合离子共存知识判断.
解答 解:(1)有颜色的离子不用做实验就能判断是否存在,溶液无色说明不含有色的Cu2+、MnO4-,故答案为:Cu2+、MnO4-;
(2)加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,沉淀不消失,说明含有Ag+,离子反应方程式为:Ag++Cl-=AgCl↓;然后取滤液加人过量的稀NaOH溶液也出现白色沉淀,该能和NaOH溶液反应的离子是Mg2+,离子反应方程式为Mg2++2OH-=Mg(OH)2↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;
(3)原溶液中含有Ag+、Mg2+离子,则一定不存在Cl-、OH-、SO32-、CO32-,可能含有的离子为NO3-,故答案为:d.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列实验操作的描述中,正确的是 ( )
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列家庭化学小实验不能达到预期目的的是
A.用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物
B.用醋、石灰水验证蛋壳中含有碳酸盐
C.用米汤检验食用加碘盐(含KIO3)中含有碘元素
D.用明矾:KAl(SO4)2·12H2O,可净化水。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色
D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动了 | B. | 物质A的转化率减小了 | ||
| C. | 物质B的质量分数增大了 | D. | 反应速率增大,且v正>v逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
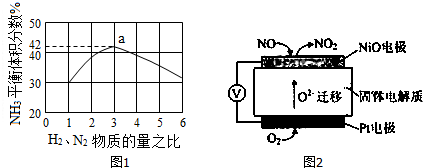
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
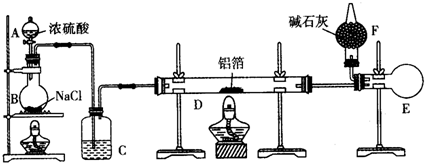
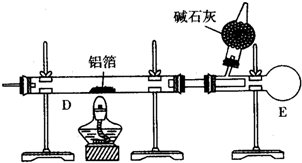
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com