
|
常温下,现有物质的量浓度均为0.1 mol/L的某一元酸HA和一元碱BOH,酸溶液的pH>1,碱溶液中c(H+)/c(OH-) ①c(B+)>c(A-)>c(OH-)>c(H+) ②c(H+)+c(B+)=c(A-)+c(OH-) ③c(B+)=c(A-)>c(H+)=c(OH-) ④c(HA)+c(A-)=c(B+) | |
| [ ] | |
A. |
①②③ |
B. |
②③④ |
C. |
①②④ |
D. |
①③④ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源:黑龙江省大庆铁人中学2011届高三上学期期末考试化学试题 题型:022
草酸(H2C2O4)是一种易溶于水的二元中强酸,在水中它的存在形态有H2C2O4、HC2O![]() 、C2O
、C2O![]() ,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:
,各形态的分布系数(浓度分数)α随溶液pH变化的关系如图所示:

(1)图中曲线1表示________的分布系数变化;曲线3表示________的分布系数变化.
现有物质的量浓度均为0.1 mol/L的下列溶液:
①Na2C2O4
②NaHC2O4
③H2C2O4
④(NH4)2C2O4
⑤NH4HC2O4
已知NaHC2O4溶液显酸性.
(2)Na2C2O4溶液中,c(Na+)/c(C2O![]() )________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
)________2(填“>”、“=”、“<”),原因是________(用离子方程式表示).
(3)常温下,向10 mL 0.1 mol/L H2C2O4溶液中滴加0.1 mol/L NaOH溶液,随着NaOH溶液体积的增加,当溶液中c(Na+)=2c(C2O![]() )+c(HC2O
)+c(HC2O![]() )时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
)时,溶液显________性(填“酸”、“碱”或“中”),且V(NaOH)________10 mL(填“>”、“=”或“<”).
(4)下列关于五种溶液的说法中,正确的是
A.
溶液②中,c(C2OB.
溶液②中,c(H2C2O4)+c(OH-)=c(C2OC.溶液④⑤中都符合c(NH![]() )+c(H+)=c(HC2O
)+c(H+)=c(HC2O![]() )+2c(C2O
)+2c(C2O![]() )+c(OH-)
)+c(OH-)
D.五种溶液都符合c(H2C2O4)+c(HC2O![]() )+c(C2O
)+c(C2O![]() )=0.1 mol·L-1.
)=0.1 mol·L-1.
(5)五种溶液中c(H2C2O4)
由大到小排列的顺序是________.(6)
配平氧化还原反应方程式:![]()
(7)
称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250 mL溶液.量取两份此溶液各25 mL,分别置于两个锥形瓶中.第一份溶液中加入2滴酚酞试液,滴加0.25 mol/L NaOH溶液至20 mL时,溶液由无色变为浅红色.第二份溶液用0.10 mol/L酸性KMnO4溶液滴定,滴定终点如何判断________.当加入16 mL 0.10 mol/L酸性KMnO4溶液时恰好反应完全.则原试样中H2C2O4·2H2O的质量分数为________,KHC2O4的质量分数为________.如果用0.25 mol/L NaOH溶液滴定第一份溶液的实验滴定终点仰视读数则测得的KHC2O4的质量分数________(填“偏高”“偏低”或“无影响”)查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
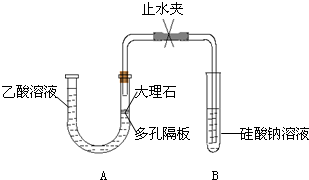
Ⅰ.探究乙酸、碳酸和硅酸的酸性强弱关系,该小组设计了如下实验装置(夹持仪器已略去)。

(1)实验前如何检查装置A的气密性?______________________________。
(2)装置A中反应产生的气体通入试管B溶液中,有白色胶状沉淀生成,说明碳酸酸性比硅酸强。
有学生认为B中的实验现象不足以证明碳酸的酸性比硅酸强,理由是:
a.乙酸易挥发,乙酸气体随CO2气体进入试管B的溶液中,和硅酸钠溶液反应生成沉淀。
b.该复分解反应生成的硅酸是难溶固体,不能说明是因为生成弱酸而发生反应。
为了证明碳酸能和硅酸钠反应生成硅酸沉淀,下列方法中可行的是__________(填序号)。
①在仪器A、B之间连接盛有足量饱和NaHCO3溶液的洗气瓶
②在仪器A、B之间连接装有足量碱石灰的干燥管
③在仪器A、B之间连接盛有足量饱和Na2CO3溶液的洗气瓶
④用碳酸钠粉末代替大理石进行实验
下列能够说明碳酸比硅酸酸性强的事实是__________(填序号)。
①相同温度时,碳酸的溶解度比硅酸的溶解度大
②碳酸比硅酸易分解
③相同温度下,相同物质的量浓度的Na2CO3和Na2SiO3溶液,Na2CO3溶液的pH比Na2SiO3溶液的pH小
④常温下,CO2是气体,SiO2是固体
Ⅱ.证明乙酸为弱酸。
现有常温下pH=3的乙酸溶液、蒸馏水、石蕊试液及pH试纸,用最简便的实验方法证明乙酸为弱酸:________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com