
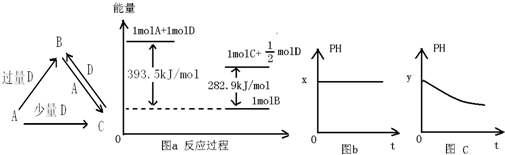
| A、在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
| B、一定条件下,铁与水蒸气反应生成8.96L H2时(已折合成标况),转移的电子数为0.8×6.02×1023 |
| C、100mL 1mol/L AlCl3与3mol/L NaCl的混合溶液中,Cl-的个数为0.6×6.02×1023 |
| D、含有非极性键的数目为6.02×1023的Na2O2与水充分反应,标况下产生O2 22.4L |
| N |
| NA |
| 80g |
| 80g/mol |
| 8.96L |
| 22.4L/mol |
| N |
| NA |
| 6.02×1023 |
| 6.02×1023/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
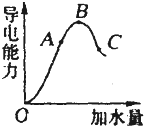 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
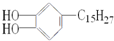 )是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )
)是我国特产生漆的主要成分,通常情况下为黄色液体,能溶于有机溶剂,生漆涂在物体的表面,在空气中干燥后变成黑色的漆膜.将漆酚放入下列物质中:①空气 ②溴水 ③小苏打溶液 ④氯化铁溶液 ⑤通入过量的二氧化碳,不能发生化学反应的是( )| A、①②⑤ | B、③④ | C、②⑤ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、存在不饱和键 |
| B、不易发生取代反应,易发生加成反应 |
| C、分子中的所有原子都处在同一条直线上 |
| D、能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、等物质的量的CH4和CO所含分子数均为NA |
| B、电解Na2SO4饱和溶液,若生成2NA个H2,一定生成NA个O2 |
| C、常温下,34.5g NO2与N2O4的混合物中含有1.5NA个氧原子 |
| D、在KClO3+6HCl═KCl+3Cl2↑+3H2O中,每生成3mol Cl2转移电子数为6NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com