
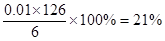


科目:高中化学 来源:不详 题型:填空题
 NaCl+NaClO+H2O ② 2Na + Cl2
NaCl+NaClO+H2O ② 2Na + Cl2 2NaCl
2NaCl  2Fe2+ + I2 ④ 2Fe2+ + Br2
2Fe2+ + I2 ④ 2Fe2+ + Br2 2Fe3+ + 2Br–
2Fe3+ + 2Br–查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2∶5 | B.1∶4 | C.4∶1 | D.5∶1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 MnO42―(绿色)(强碱性条件)
MnO42―(绿色)(强碱性条件) Mn2+(无色)+ 4H2O(强酸性条件)
Mn2+(无色)+ 4H2O(强酸性条件)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,①中的 Fe2+作 剂。
,①中的 Fe2+作 剂。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

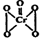 ),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为 , 请写出反应的离子方程式: 。
),该反应可用来检验Cr2072-的存在。过氧化铬中铬元素的化合价为 , 请写出反应的离子方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 Se+2I2+4KNO3+2H2O;
Se+2I2+4KNO3+2H2O; 2SO2↑+SeO2+2H2O下列有关叙述正确的是
2SO2↑+SeO2+2H2O下列有关叙述正确的是| A.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2。 |
| B.①中Se是氧化产物,I2是还原产物 |
| C.反应①中KI是氧化剂,SeO2是还原剂 |
| D.反应①中每有0.6 mol I2生成,转移电子数目为2.4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com