
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C | 原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
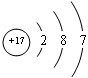 ;Na元素最高价氧化物对应水化物为NaOH,NaOH是离子化合物,由钠离子和氢氧根离子构成,其电子式为
;Na元素最高价氧化物对应水化物为NaOH,NaOH是离子化合物,由钠离子和氢氧根离子构成,其电子式为 .
. ;
; .
.

科目:高中化学 来源: 题型:
| 元素 代号 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/nm | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 | 0.102 | 0.143 |
| 最高或最低化合价 | -2 | +2 | +1 | +5 -3 |
+7 -1 |
+1 | +5 -3 |
+3 | +6 -2 |
+3 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.089 | 0.074 |
主要化合价 | +2 | +3 | +6,-2 | +2 | -2 |
(1)用元素代号标出它们在周期表中对应位置

(2)C、E形成化合物为______________(填化学式),周期表有些元素存在“对角线相似”现象,请写出D的单质与强碱溶液反应的离子方程式:______________________;并用电子式表示其氯化物的形成过程____________________________________________________________。
(3)有一类无机化合反应的通式可以表示为:单质+化合物(1)=化合物(2)。请写出满足以下要
求的4个此类无机化合反应的化学方程式:
①所涉及的元素的原子序数都小于30,②4种单质分属4个不同族。
_______________________________________,_______________________________________,
_______________________________________,_______________________________________。
(4)M为金属元素铼(Re),铼是自然界中最后一种被诺达克等三位科学家于1926年发现的元素。他们从数以吨计的含有多种元素的矿石中,通过复杂的工艺一点一滴地富集浓缩,才制得了仅2mg的金属铼。现代工业上采用的方法是:于
①元素铼的原子序数为_____________,铼元素发现如此艰难和时间上如此漫长的原因:
____________________________________________________________________。
②写出现代工业上用氢气冶炼金属铼的化学方程式,并标出电子转移的方向和数目:_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:

(1)写出A、B、C、D、E五种元素符号 、 、 、 、 。
(2)画出B的原子结构示意图: ;写出D元素最高价氧化物对应水化物的电子式: 。
(3)盐X水溶液显 (选填“酸”、“碱”或“中”)性,用离子方程式解释其原因: 。
(4)D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 。
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为
,Y所含的化学键为 。
(a)极性键 (b)非极性键 (c)离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com