
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
分析 苯分子(C6H6)尽管很不饱和但却不能与溴水反应,不能与酸性KMnO4溶液反应,这是明显不同于一般的烯烃性质的事实,以此解答该题.
解答 解:A、凯库勒式结构也是一个高度对称的平面性结构,不能说明与烯烃的性质不同,故A错误;
B、苯不溶于水,与溴水混合后溶液分层,故B错误;
C、苯中不含碳碳双键,因此不能被酸性高锰酸钾溶液氧化,故C正确;
D、苯和氯气不发生加成反应,可与氢气在一定条件下发生加成反应,故D错误;
故选C.
点评 本题考查有机物的结构和性质,侧重考查苯与烯烃结构的区别和性质的差异,题目难度不大,掌握苯的结构和性质是解题的关键,平时学习时注意不同类物质结构和性质的比较.


科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 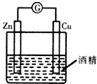 形成原电池 | B. | 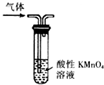 除去乙烯中混有的SO2 | ||
| C. | 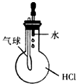 验证HCl气体在水中的溶解性 | D. | 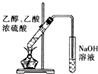 实验室制取乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
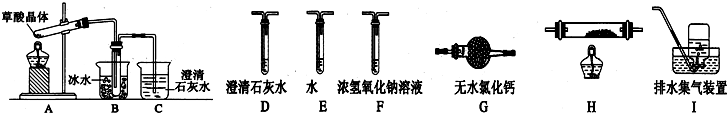
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
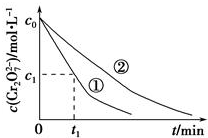 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
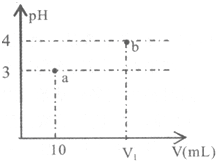
| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com