
为了说明影响化学反应快慢的因素,甲、乙、丙、丁四位学生分别设计了如下A~D四个实验,你认为得出的结论不正确的是 ( )
A.在相同条件下,等质量的大理石块和大理石粉与相同的盐酸反应,大理石粉反应快
B.将相同大小、形状的镁条和铝条分别与相同浓度的盐酸反应时,两者速率一样大
C.将浓硝酸分别放在冷暗处和强光照射下,会发现光照可以加快浓硝酸的分解
D.两支试管中分别加入相同浓度相同体积的双氧水,其中一支试管中再加入几滴氯化铁溶液,产生氧气的快慢不同
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(浙江卷解析版) 题型:选择题
下列说法正确的是
A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
B.为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C.用0.2000 mol/L NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol/L),至中性时,溶液中的酸未被完全中和
D.相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1mol/L盐酸、③0.1 mol/L氯化镁溶液、④0.1mol/L硝酸银溶液中,Ag+浓度:①>④=②>③
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(山东卷解析版) 题型:选择题
(3分)(2012?山东)下列关于原子结构、元素性质的说法正确的是( )
A.非金属元素组成的化合物中只含共价键
B.ⅠA族金属元素是同周期中金属性最强的元素
C.同种元素的原子均有相同的质子数和中子数
D.ⅦA族元素的阴离子还原性越强,其最高价氧化物对应水化物的酸性越强
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
(6分)按要求回答下列问题
(1)把锌片投入到盛有盐酸的敞口容器中,产生H2的速率可由图⑴表示。
在下列因素中对产生H2速率有影响的是
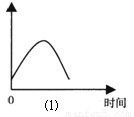
①盐酸的浓度 ②锌片的表面积 ③溶液的温度 ④Cl-的浓度
A.①④ B.③④ C.①②③ D.②③
(2)若向等量的两份稀硫酸a和b中, 分别加入过量的锌粉, 并向a中加入少量铜粉, 下图表示产生H2的体积(V)与时间(t)的关系正确的是 ,若向a中加入少量CH3COONa固体,图像正确的是
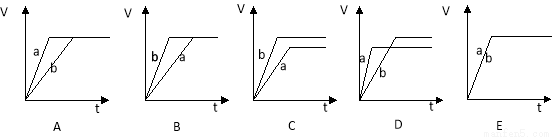
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是
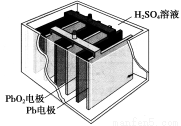
A.PbO2是电池的负极
B.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强
C.放电时,电子由Pb电极通过导线流向PbO2
D.正极的电极反应式为Pb-2e-=Pb2+
查看答案和解析>>
科目:高中化学 来源:2012-2014四川省宜昌市春季期中考试高一化学试卷(解析版) 题型:选择题
下列各种说法中,正确的是 ( )
A.3号到9号元素化合价的变化与11到17号元素化合价的变化完全相同
B.同周期原子半径逐渐减小,所以离子半径也逐渐减小
C.随着原子序数的递增,碱金属元素单质的还原性逐渐增强,阳离子的氧化性逐渐减弱
D.甲乙电子层数相同,甲的最高价氢氧化物的碱性比乙的最高价氢氧化物的碱性强,说明甲的核电荷数比乙大
查看答案和解析>>
科目:高中化学 来源:2012-2013陕西省富平县高一下学期期末考试化学试卷(解析版) 题型:填空题
(4分)下列各组粒子,属于同种核素的是 (填编号,下同),互为同位素的是 ,互为同素异形体的是 ,互为同分异构体的是 。
① 16O2和18O3 ②质子数相同而中子数不同的两种粒子
③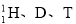 ④
④ 和
和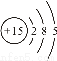 (核内15个中子)
(核内15个中子)
⑤葡萄糖和果糖 ⑥
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高一上学期期末化学试卷(解析版) 题型:填空题
(1)写出工业用纯碱、石灰石、石英制普通玻璃的化学方程式 ; 。
(2)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。原因是 (用化学方程式表式)
(3)向100ml水中投入Na和Al共16克,充分反应后分析剩余金属1g。计算放出H2的体积为 升(标准状况下)
(4)向含有0.3mol的NaAlO2溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为 mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml) mol/L
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省高一上学期期中考试化学试卷(解析版) 题型:选择题
在同温、同压条件下,两种物质的量相同的单质气体之间的关系是( )
①具有相同的密度 ②具有相同的体积 ③具有相同的原子数 ④具有相同的分子数
A.①③ B.②④ C.①④ D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com