
������(Si3N4)��һ�������մɲ��ϣ�������ʯӢ�뽹̿�ڸ��µĵ������У�ͨ�����·�Ӧ�Ƶã�3SiO2(s)+6C(s)+ 2N2(g) 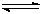 Si3N4(s) + 6CO(g)
Si3N4(s) + 6CO(g)
(1)�÷�Ӧ���������� ��2molN2�μӷ�Ӧת�Ƶ�����Ϊ ��
(2) �ﵽƽ��ı�ijһ������������ı�N2��CO����������Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ��ͼ��t4ʱ����ƽ���ƶ������������� ��ͼ�б�ʾƽ��������CO�ĺ�����ߵ�һ��ʱ���� ��
(3)���÷�Ӧ��ƽ�ⳣ��Ϊ K��729������ͬ�¶���1L�ܱ������У�������SiO2��C��2mol N2��ַ�Ӧ����N2��ת������
(��ʾ��272 = 729)

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ԭ�Ӻ���ԭ�ӵĺ�������Ų�,��Cl2��HCl�������γɵĹ��ۼ�������ȷ��
A�����߶�Ϊs s �Ҽ�
s �Ҽ�
B�����߶�Ϊp p �Ҽ�
p �Ҽ�
C��ǰ��Ϊp p �Ҽ�,����Ϊs
p �Ҽ�,����Ϊs p �Ҽ�
p �Ҽ�
D��ǰ��Ϊs s �Ҽ�,����Ϊs
s �Ҽ�,����Ϊs p �Ҽ�
p �Ҽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����С�մ�ˮ��Һ�ı�����ȷ����
A. c(Na+) = 2c(HCO3��) + 2c(CO32��) + 2c(H2CO3)
B. c(Na+)+ c(H+) = c(HCO3��) + c(OH��) + c(CO32��)
C. HCO3���ĵ���̶ȴ���HCO3��ˮ��̶�
D. ���ڵĵ�����NaHCO3 = Na+ + HCO3���� HCO3��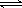 CO32�� + H+��H2O
CO32�� + H+��H2O 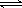 H+ + OH��
H+ + OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��1L 0.1 mol��L��1 BaCl2��Һ������ϡ�����ַ�Ӧ�ų�a kJ��������1L 0.5 mol��L��1 HCl��Һ������CH3COONa��Һ��ַ�Ӧ�ų�b kJ����(�����Ǵ�����ˮ��)����0.5L 1 mol��L��1 H2SO4��Һ������(CH3COO)2Ba(������ǿ�����)��Һ��Ӧ�ų�������Ϊ( )
A��(5a��2b) kJ B��(4b��10a) kJ C��(5a��2b) kJ D��(10a��4b) kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ����CO����ȼ�ϼ״���һ���¶Ⱥ��ݻ������·�����Ӧ��CO(g)+2H2(g) CH3OH(g)��ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
CH3OH(g)��ͼ1��ʾ��Ӧ�е������仯��ͼ2��ʾһ���¶��£������Ϊ1L���ܱ������м���2mol H2��һ������CO��CO��CH3OH(g)��Ũ����ʱ��仯��
��ش��������⣺
(1)�ڡ�ͼ1���У����� (�a����b��)��ʾʹ���˴�����û��ʹ�ô���ʱ���ڸ��¶Ⱥ�ѹǿ�����·�ӦCO(g)+2H2(g) CH3OH(g)����H = ��
CH3OH(g)����H = ��
(2)�ӷ�Ӧ��ʼ������ƽ�⣬v(CO)= �����¶���CO(g)+2H2(g) 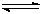 CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ ���ﵽƽ���������������������,����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____�����������С�����䡱����
CH3OH(g)�Ļ�ѧƽ�ⳣ��Ϊ ���ﵽƽ���������������������,����Ӧ��ϵ���£���÷�Ӧ��ѧƽ�ⳣ��____�����������С�����䡱����
(3)��֪CH3OH(g)��3/2O2(g)��CO2(g)��2H2O(g)��H����193kJ/mol����֪H2O(l)= H2O(g) ��H����44 kJ/mol����д��32g��CH3OH(g)��ȫȼ������Һ̬ˮ���Ȼ�ѧ����ʽ  ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ���������ж�Ԫ�ؽ�����ǿ�����ǣ� ��
A��1 mol���������ڷ�Ӧ��ʧȥ���ӵĶ���
B����������֮�䷢�����û���Ӧ
C������Ԫ������������Ӧ��ˮ����ļ���ǿ��
D������Ԫ�صĵ�����ˮ�����û������������׳̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���г����ʵIJ����в���ȷ���ǣ� ��
A�������л������ۣ���������ռ���Һ��ַ�Ӧ�����
B��FeCl2��Һ�л���FeCl3������������۳�ַ�Ӧ�����
C��Na2CO3�����л�������NaHCO3����������NaOH��Һ
D�������л��������Ȼ������壺���������ͨ��ʢ����ʳ��ˮ��ϴ��ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ʵ�ת���ڸ�����������ʵ�ֵ���
��NaAlO2(aq) AlCl3
AlCl3 Al �� NH3
Al �� NH3 NO
NO HNO3
HNO3
��NaCl(����)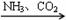 NaHCO3
NaHCO3 Na2CO3 ��FeS2
Na2CO3 ��FeS2 SO3
SO3 H2SO4
H2SO4
A���ڢ� B���٢� C���ڢ� D���ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�����ڱ��У��������ġ��塢������Ԫ�ص���Ŀ�ֱ��� �� ��
A��8��8��18��32 B��8��18��18��32
C��8��18��18��18 D��8��8��18��18
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com