
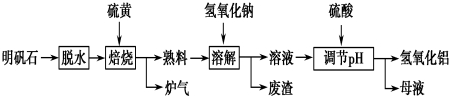
分析 根据元素守恒和得失电子守恒,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质.
(1)根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验;
(4)“母液”中含有硫酸盐;
(5)依据化学方程式中定量关系确定明矾石的主要成分为K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量,结合铝元素守恒计算得到氢氧化铝的理论值.
解答 解:根据元素守恒和得失电子守恒,硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,可知焙烧炉中发生反应,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)硫酸铝和硫单质发生的是氧化还原反应,氧化产物和含有产物为二氧化硫,反应中硫元素化合价由Al2(SO4)3中S元素的+6价降低,单质硫中S的化合价升高,令产物中S的化合价为+x价,根据得失电子守恒可知6(6-x)=3(x-0),则x=4,所以生成产物为SO2,则反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,
故答案为:2,3,2,9SO2;
(2)分离溶液和废渣的操作用过滤,氢氧化钠与氧化铝反应生成偏铝酸钠和水,反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:过滤,Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3沉淀具有吸附性,可吸附硫酸根离子,通过检验硫酸根离子的方法进行实验,方法为取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净,
故答案为:取最后一次洗涤的流出液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净;
(4)根据流程分析可知“母液”中含有硫酸盐中含有K2SO4、Na2SO4,都可回收利用,
故答案为:K2SO4;Na2SO4;
(6)氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀,故答案为:氢氧化铝具有两性,能与硫酸反应,不严格控制pH值,会导致氢氧化铝溶解,从而得不到氢氧化铝沉淀;
(5)2Al2(SO4)3+3S$\frac{\underline{\;\;△\;\;}}{\;}$2Al2O3+9SO2,依据铝元素守恒计算,若“焙烧”过程中恰好消耗48g硫黄物质的量=$\frac{48g}{32g/mol}$=1.5mol,反应的2Al2(SO4)3物质的量为1mol,K2SO4•Al2(SO4)3•2Al2O3•6H2O物质的量为1mol,
K2SO4•Al2(SO4)3•2Al2O3•6H2O~6Al(OH)3,
1 6×78
1mol m
则理论上最终可得到m=468g
故答案为:468.
点评 本题考查物质的制备、分离等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,题目难度中等,注意把握物质的相关性质.


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:选择题
| A. | 920kJ | B. | 557kJ | C. | 436kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氟化氢气体分解生成氢气和氟气的反应是放热反应 | |
| B. | 1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270kJ | |
| C. | 在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 | |
| D. | 放热反应的反应速率总是大于吸热反应的反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘酒是指碘单质的乙醇溶液 | |
| B. | 浓硫酸可以刻蚀石英制艺术品 | |
| C. | 84消毒液的有效成分是NaClO | |
| D. | 氢氧化铝、小苏打等可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com