
| |||||||||||||||||||
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
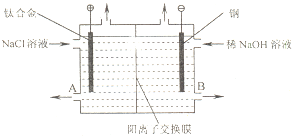 电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.
电解食盐水使用的离子交换膜电解槽装置如图所示.经过净化精制的饱和食盐水不断送入阳极室,向阴极室不断加入稀NaOH溶液.阳离子交换膜具有很好的选择性,它只允许阳离子通过.查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
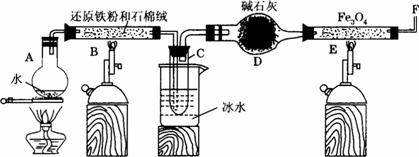
(1)为防止A中液体暴沸,可以采取的措施是___________;装置D能否改用盛有浓硫酸的洗气瓶___________。
(2)反应3Fe+4H2O(g)====Fe3O4+4H2↑在一定条件下实际为可逆反应,本实验中是如何实现Fe向Fe3O4的转变的?试用化学平衡移动原理加以解释__________________________________。
(3)停止反应,待B管冷却后,取其中固体加入过量稀盐酸,充分反应后过滤。简述证明滤液中含有Fe3+的实验操作及现象_____________________________________________________。
(4)若E管中反应按以下两步进行:Fe3O4+H2====3FeO+H2O,FeO+H2====Fe+H2O,假设实验开始时E管中的Fe3O4为23.
①Fe ②Fe租Fe3O4 ③FeO和Fe3O4 ④Fe和FeO ⑤Fe、FeO和Fe3O4
用此20 g固体与铝粉在一定条件下进行铝热反应,最多可消耗铝粉_________g(不考虑空气中的成分参与反应)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com