
 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
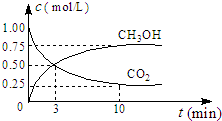
| n(CH3OH) |
| (CO2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| 0.25mol/L |
| 10min-3min |
| 0.25 |
| 7 |
| 0.75 |
| 7 |
| m |
| V |


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:
 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示):
X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;x2-和Y+有相同的核外电子排布;Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气态单质.回答下列问题(相关回答均用元素符号或化学式表示):查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.
如图表示一个电解池.X、Y都是惰性电极,电解液a是饱和食盐水,同时在两边各滴入几滴酚酞试液.查看答案和解析>>
科目:高中化学 来源: 题型:
 和
和 ; ②
; ② 和
和 ;
;| 类别 | 同系物 | 同素异形体 | 同分异构体 |
| 组号 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 每100g含有 营养成分 |
糖类 | 油脂 | 蛋白质 | 维生素C | 钙 | 镁 | 钠 | 锌 |
| 7.6g | 7.8g | 7.4g | 18mg | 201mg | 18.2mg | 30.8mg | 8.1mg |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,a个-CH3,其余为-Cl,则Cl的个数为( )
,a个-CH3,其余为-Cl,则Cl的个数为( )| A、2n+3m-a |
| B、m+2-a |
| C、n+m+a |
| D、m+2n+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 称量氢氧化钠固体 |
B、 分离苯、水混合物 |
C、 配制150mL 0.10mol?L-1盐酸 |
D、 分离沸点相差较大的互溶液体混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com