
| A. | 丙烯分子中3个碳原子都是sp3杂化 | |
| B. | 丙烯分子存在非极性键 | |
| C. | 丙烯分子有6个σ键,1个π键 | |
| D. | 丙烯分子中3个碳原子在同一直线上 |
分析 A.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化;
B.同种非元素之间形成非极性键;
C.C-C、C-H键均为σ键,C=C中一个σ键,一个π键;
D.由C=C双键为平面结构、甲基为四面体结构分析.
解答 解:A.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故A错误;
B.同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,故B正确;
C.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故C错误;
D.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故D错误;
故选B.
点评 本题考查共价键及分类、杂化类型的判断,注意判断共价键的规律和常见有机物的空间结构来解答,杂化类型为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
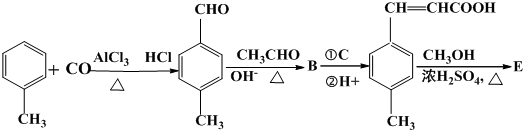
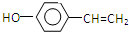 ;
;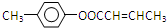 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为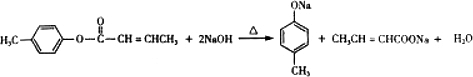 .
.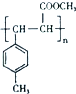 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体类型 | 原子晶体 | 离子晶体 | 分子晶体 |
| A. | 氮化硅 | 磷酸 | 单质硫 |
| B. | 单晶硅 | 碳酸氢铵 | 水银 |
| C. | 金刚石 | 烧碱 | 冰 |
| D. | 铁 | 尿素 | 冰醋酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
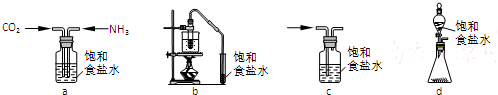
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 | B. | 还原性(碱性溶液):Fe(OH)2>I2>KIO3 | ||
| C. | 热稳定性:NaCl>NaClO>NaClO4 | D. | 酸性(水溶液):H2CO3>HSCN>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
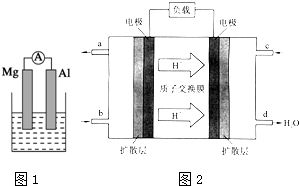 据图回答下列问题:
据图回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com