
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
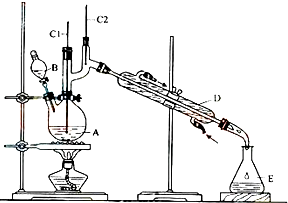
分析 (1)不能将Na2Cr2O7溶液加到浓硫酸中,因为浓硫酸的密度大,容易发生迸溅;
(2)加入沸石的作用是防止暴沸;
(3)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(4)分液漏斗使用前必须检漏;
(5)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
解答 解:(1)因为浓硫酸的密度大,将Na2Cr2O7溶液加到浓硫酸中,容易发生迸溅,故答案为:不能,容易发生迸溅;
(2)加入沸石的作用是防止暴沸,故答案为:防止暴沸;
(3)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管,故答案为:分液漏斗;直形冷凝管;
(4)分液漏斗使用前必须检漏,故选c;
(5)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,故答案为:下;
(6)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(7)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$=51.4%,
故答案为:51.4.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
 氯气的实验室制法
氯气的实验室制法查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置来合成正丁醚(其它装置均略去),发生的主要反应为:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 苯甲酸的分子式为C6H5COOH,分子结构为
苯甲酸的分子式为C6H5COOH,分子结构为 ,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯.
,是苯环上的一个氢被羧基(-COOH)取代形成的化合物.其化学性质与乙酸类似,具有弱酸性,并可以和乙醇发生酯化反应生成苯甲酸乙酯. +CH3CH2OH$?_{△}^{浓硫酸}$
+CH3CH2OH$?_{△}^{浓硫酸}$ +H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.
+H2O;实验中使用分水器的目的是分离出生成的水,有利于平衡向生成乙酸正丁酯的方向移动;.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与Al反应放出氢气的溶液中:Na+、H+、NH4+、NO3- | |
| B. | 在c(H+)=1.0×10-13,mol/L的溶液中:Na+、K+、AlO2-、CO32- | |
| C. | 澄清透明的溶液中:Fe3+、Mg2+、NO3-、S2- | |
| D. | 在pH=1的溶液中:NH4+、K+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | 实验室常用KSCN溶液检验Fe3+ |
| B | SO2有较强的还原性 | SO2可使酸性KMnO4溶液褪色 |
| C | 浓硫酸可干燥NO和SO2 | NO和SO2还原性都弱 |
| D | 浓硫酸有吸水性 | 浓硫酸可用于干燥氨气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com