
����Ŀ����10L�����ܱ������з�����Ӧ��X��g��+Y��g��2Z��g����H��0��T��ʱ�������ʵ����ʵ�����ʱ���ϵ���±�������˵����ȷ���ǣ� ��
ʱ��/min | n��X��/mol | n��Y��/mol | n��Z��/mol |
0 | 0.20 | 0.60 | 0 |
10 | a1 | a2 | 0.25 |
13 | b1 | 0.45 | b2 |
15 | d1 | d2 | 0.30 |
A.ǰ10 min�ڵ�ƽ����Ӧ����v��Y��=2.5��10��3 mol/��Lmin��
B.���������������䣬�����¶ȣ���Ӧ��ƽ��ʱc��X����5.0��10��3 mol/L
C.����ʼʱֻ����0.60 mol Z��g������Ӧ��ƽ��ʱZ��g����ת����Ϊ50%
D.����ʼʱ����0.60 mol X��g����0.10 mol Y��g����0.50 mol Z��g�����ﵽƽ��ǰv��������v���棩
���𰸡�C
���������⣺A��ǰ10 min��Z�����ʵ����仯��Ϊ0.25mol���������Ϊ10L����v��Z��= ![]() =0.0025mol/��L��min��=������֮�ȵ����仯ѧ������֮�ȣ���v��Y��=
=0.0025mol/��L��min��=������֮�ȵ����仯ѧ������֮�ȣ���v��Y��= ![]() v��Z��=
v��Z��= ![]() ��0.0025mol/��L��min��=v��Z��=0.00125mol/��L��min������A���� B.13minʱY�����ʵ����仯��Ϊ0.6mol��0.45mol=0.15mol����Z�����ʵ����仯Ϊ0.15mol��2=0.3mol����13minʱZ�����ʵ���Ϊb2=0.3mol����15minʱZ�����ʵ���ҲΪ0.3mol����13minʱ��Ӧ����ƽ�⣬��X��g��+Y��g��2Z��g������֪�μӷ�ӦXΪ0.15mol����ƽ��ʱX�����ʵ���b1=0.2mol��0.15mol=0.05mol����ƽ��ʱc��X��=
��0.0025mol/��L��min��=v��Z��=0.00125mol/��L��min������A���� B.13minʱY�����ʵ����仯��Ϊ0.6mol��0.45mol=0.15mol����Z�����ʵ����仯Ϊ0.15mol��2=0.3mol����13minʱZ�����ʵ���Ϊb2=0.3mol����15minʱZ�����ʵ���ҲΪ0.3mol����13minʱ��Ӧ����ƽ�⣬��X��g��+Y��g��2Z��g������֪�μӷ�ӦXΪ0.15mol����ƽ��ʱX�����ʵ���b1=0.2mol��0.15mol=0.05mol����ƽ��ʱc��X��= ![]() =5.0��10��3 mol/L������ӦΪ���ȷ�Ӧ�����������������䣬�����¶ȣ�ƽ�����淴Ӧ�����ƶ���X��Ũ��������Ӧ��ƽ��ʱc��X����5.0��10��3 mol/L����B����
=5.0��10��3 mol/L������ӦΪ���ȷ�Ӧ�����������������䣬�����¶ȣ�ƽ�����淴Ӧ�����ƶ���X��Ũ��������Ӧ��ƽ��ʱc��X����5.0��10��3 mol/L����B����
C����B�м����֪��ƽ��ʱX��Y��Z�����ʵ����ֱ�Ϊ0.05mol��0.45mol��0.3mol�����ڷ�Ӧǰ�����廯ѧ��������ȣ��������ʵ�������Ũ�ȼ���ƽ�ⳣ������ƽ�ⳣ��K= ![]() =
= ![]() =4��
=4��
�赽��ƽ��ʱ�μӷ�ӦZΪn mol����
X��g��+ | Y��g�� | 2Z��g�� | |
��ʼ��mol�� | 0 | 0 | 0.6 |
ת����mol�� | 0.5n | 0.5n | n |
ƽ�⣨mol�� | 0.5n | 0.5n | 0.6-n |
�� ![]() =4�����n=0.3����Z��ת����Ϊ
=4�����n=0.3����Z��ת����Ϊ ![]() ��100%=50%����C��ȷ��
��100%=50%����C��ȷ��
D����ʱŨ����Qc= ![]() =
= ![]() ��K=1���ʷ�Ӧ���淴Ӧ������У���v��������v���棩����D����
��K=1���ʷ�Ӧ���淴Ӧ������У���v��������v���棩����D����
��ѡ��C��
�����㾫�������ջ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������кͷ�Ӧ�ı����ǣ�H+ + OH�� = H2O���������ʼ�ķ�Ӧ�������������ӷ���ʽ��ʾ����( )
A. ����������ϡ���ᷴӦ B. Ba(OH)2��Һ����ϡ������
C. ����ʯ��ˮ��ϡ���ᷴӦ D. ��ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���з�����Ӧ�����ӷ���ʽΪ��Zn��2H��=Zn2����H2��������˵���������
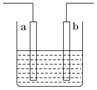
A. a��b��������ͬ�ֲ��ϵĵ缫
B. ��װ�ÿ����ǵ��أ��������ҺΪϡ����
C. ��װ�ÿ�����ԭ��أ��������ҺΪϡ����
D. ��װ�ÿɿ�����ͭ��пԭ��أ��������Һ��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������100mL 1mol/L NaOH��Һ����������ǣ�������
A. ��Ͳ B. �Թ� C. ����ƿ D. ��Һ©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ�����0.1mol/L������Һ����μ����Ũ�ȵ�NaOH��Һ����Һ��pOH��pOH=��lg[OH��]����pH�ı仯��ϵ��ͼ��ʾ���� �� 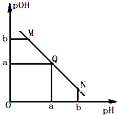
A.M����ʾ��Һ��������ǿ��Q��
B.N����ʾ��Һ��c��CH3COO������c��Na+��
C.M���N����ʾ��Һ��ˮ�ĵ���̶���ͬ
D.Q������NaOH��Һ��������ڴ�����Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У�������ˮ���ǣ�������
A. KNO3 B. CaCO3 C. AgCl D. CuO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij����̶����ܱ������м���0.3 mol A��0.1 mol C��һ������δ֪����B�������壬һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼ��ʾ����֪�ڷ�Ӧ�����л�������ƽ����Է�������û�б仯����ش�

��1���ܱ������������_____L��
��2����t1=15ʱ����t0~t1 s����C����Ũ�ȱ仯��ʾ�ķ�Ӧ����v(C)=_______��
��3��д����Ӧ�Ļ�ѧ����ʽ��________________________��
��4��t1 sʱ��A��ת����Ϊ__________����ʱv(A)��______v(B)����ѡ�>������<����=������
��5��B����ʼ�����ʵ�����_____��
��6��ƽ��ʱ��ϵ�ڵ�ѹǿΪ��ʼ״̬��___________����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С���ͬѧ����ʵ������п��Ũ���ᷴӦ��ʵ��ʱ����ͬѧ��Ϊ�����������Ƕ���������ͬѧ��Ϊ���������������⣬�����ܲ���������Ϊ����֤�ס�����λͬѧ���ж��Ƿ���ȷ����ͬѧ�������ͼ��ʾ��ʵ��װ�ã�п��Ũ���Ṳ��ʱ����������ΪX����Ӧװ����ȥ����
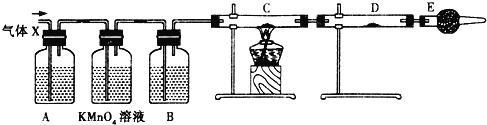
ע��C��Ϊ����ͭ��ĩ���Իش��������⣺
��1��������Ӧ�����ɶ�������Ļ�ѧ����ʽΪ��________________________________��
��2����ͬѧ��Ϊ�����ܲ��������������ǣ�____________________________________��
��3����ͬѧ�ڰ�װ��װ�úز����ٵ�һ�������ǣ�__________________________��
��4��A���Լ���______��D���Լ���______��
��5��Eװ�õ�������_________________________��
��6������֤������X�к���������ʵ�������ǣ�______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������˵����ȷ�ǣ� ��
A.���к���Ԫ�صĻ������ж��������������ȷ��»���ǿ
B.H2O��һ�ַdz��ȶ��Ļ������������ˮ���Ӽ��γ��������
C.��ԭ�Ӻͷǽ����Ժ�ǿ��Ԫ��ԭ�ӣ�F��O��N���γɵĹ��ۼ�����Ϊ���
D.���Ӽ��γɵ����ʹ��Ӧ���ʵ��۵�ͷе����ߣ����Ҳ�ɴ����ڷ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com