
2014 年 3  月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
月 21 日是第二十二届“世界水日”,保护水资源,从我做起!
(1)ClO2和Cl2(还原产物都为Cl-)是生活中常用的消毒剂。当消耗等物质的量的两种物质时,ClO2的消毒效率是Cl2的____________倍。
2)某无色废水中可能含有 Fe3+、Al3+、Mg2+、Na+、NO-、CO32-、SO42-离子中的几种,为分析其成分,分别取废水样品 100 mL,进行了三组实验,其操作和有关现象如下图所示:
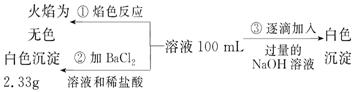
请根据上图回答下列问题:
①实验中需配制 1.0 mol/L的NaOH溶液100 mL,所需仪器除了玻璃棒、托盘天平、量筒、药匙、烧杯、胶头滴管, 还缺少的仪器为_________。
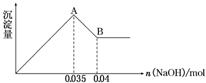
②实验③中沉淀量由 A→B过程中所发生反应的离子方程式为__________。
③试确定NO3-是否存在?_______(填“存在”、“不存在”或“不确定”),若存在,试计算 c(NO3-)=____________(若不存在,此问不必作答)。
【知识点】元素化合物、离子推断A3 B1 D5 C5
【答案解析】(1)2.5
(2)①100mL容量瓶 ②Al(OH)3+OH-=AlO2-+2H2O ③存在 0.15mol/L
解析:⑴消耗1mol ClO2得到电子5mol、消耗1molCl2得到电子2mol,ClO2的消毒效率是Cl2的2.5倍⑵根据废水无色知无Fe3+,根据焰色反应呈无色知没有Na+,根据实验②产生白色沉淀知有SO42-,而且其物质的量为2.33/233=0.01mol,根据实验③确定有Al3+和Mg2+,因为CO32-与Al3+不能共存,所以无CO32-,因此溶液中存在的离子为:Al3+、Mg2+、SO42-,根据图象可知Al(OH)3的物质的量为0.005mol,溶解氢氧化铝消耗OH-为0.005mol,生成氢氧化铝沉淀消耗OH-为0.015mol,则生成氢氧化镁沉淀消耗OH-为0.035mol-0.015mol=0.02mol,则Mg2+为0.01mol,根据电荷守恒知NO3-的物质的量为0.005×3+0.01×2-0.01×2=0.015mol,c(NO3-)=0.15mol/L;A→B段的反应是氢氧化铝的溶解Al(OH)3+OH-=AlO2-+2H2O;配制 1.0 mol/L的NaOH溶液100 mL还需100mL容量瓶。
【思路点拨】根据离子共存和实验现象分析判断离子组成;根据物质发生的反应及图像的起点、转折点、终点和曲线变化的意义进行分析计算。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
目前,世界上生产的镁有60%来自海水,其生产流程图如下

⑴贝壳的主要化学成分为 。(写化学式)
⑵写出反应②的离子方程式: 。
⑶写出Mg与CO2反应的化学方程式 。
⑷电解氯化镁所得的氯气,除用于生产盐酸外,请举出氯气在工业上的另一种用途(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加得德罗常数的数值,下列叙述中正确的是( )
|
| A. | 1molNH3所含有的原子数为NA |
|
| B. | 常温常压下,22.4L氧气所含的原子数为2NA |
|
| C. | 常温常压下,48gO3所含的氧原子数为3NA |
|
| D. | 1L0.1mol/LNaCL溶液中所含的Na+为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
简答题:现有四瓶失去标签的溶液,分别是硫酸铜溶液、氯化铵溶液、硝酸钾溶液和稀硫酸.请你设计简单的实验方案帮助实验员将它们区分开来. 溶液为蓝色的是硫酸铜,分别取剩余的三种溶液少许于试管中,加氢氧化钠溶液,加热,有气体生成的是氯化铵溶液,无明显变化的是硝酸钾溶液和稀硫酸,另取少量的剩下的两种溶液于试管中,分别滴加少量氯化钡溶液,有白色沉淀生成的是稀硫酸,无明显变化的是硝酸钾溶液 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知硫酸亚铁溶液中加入过氧化钠时发生反应:
4Fe2++4Na2O2+6H2O= 4Fe(OH)3↓+O2↑+8Na+ 则下列说法正确的是( )
A、该反应中 Fe2+是还原剂,O2 是还原产物
B、4molNa2O2 在反应中共得到 8NA 的电子
C、Fe(OH)3 既是氧化产物又是还原产物,每生成 4mol Fe(OH)3 反应过程中共转移电子 6mol
D、反应过程中可以看到白色沉淀转化为灰绿色再转化为红褐色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于CO2和SiO2性质的说法中,不正确的是( )。
A.CO2通入到水玻璃中可以得到硅酸
B.CO2与SiO2在物理性质上差别很大
C.SiO2与CaCl2溶液不反应,而CO2通入CaCl2溶液中可得到白色沉淀
D.CO2和SiO2都是酸性氧化物,都能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写不正确的是( )。
A.往NaOH溶液中通入过量CO2:CO2+OH-==HCO3-
B.H2SiO3与NaOH溶液混合:2OH-+H2SiO3==2H2O+SiO32-
C.石英砂与烧碱反应制水玻璃:SiO2+2OH-==SiO32-+H2O
D.往水玻璃中通入二氧化碳:Na2SiO3+H2O+CO2==H2SiO3↓+2Na++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得 BeCl2为共价化合物,两个Be—Cl键间的夹角为180°则BeCl2属于
A.由极性键构成的极性分子 B.由极性键构成的非极性分子
C.由非极性键构成的极性分子 D.中心原子采用sp2杂化的分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com