
【题目】设计实验,对下列物质所含官能团进行检验。
(1)为了证明溴乙烷中存在溴原子,某同学设计如下实验:

① 将试管C中加入的试剂及相应的实验现象补充完整:_______。
② 溴乙烷在NaOH水溶液中反应的化学方程式是______。
(2)用化学方法检验![]() 含有的官能团。
含有的官能团。
① 完成下表:
官能团 | 检验试剂 | 实验现象 | 化学方程式 |
—OH | FeCl3溶液 | 溶液呈紫色 |
|
—COOH | _______ | 有无色气泡产生 | _______ |
② 不能用溴水检验是否含有碳碳双键,简述理由:_______。
【答案】加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成 CH3CH2Br + NaOH![]() CH3CH2OH + NaBr NaHCO3溶液
CH3CH2OH + NaBr NaHCO3溶液 ![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O 该有机物可与溴水发生取代反应而使溴水褪色
+ CO2↑+ H2O 该有机物可与溴水发生取代反应而使溴水褪色
【解析】
(1)溴乙烷与氢氧化钠水溶液在加热的条件下会发生水解反应生成乙醇与溴化钠,上层清液中含溴离子,可以稀硝酸酸化的硝酸银可以检验反应产物中的溴离子,据此分析作答;
(2)![]() 所含官能团为酚羟基、碳碳双键和羧基,①羧酸是有机酸,其酸性强于碳酸,可与碳酸氢钠反应生成二氧化碳,因此碳酸氢钠可用于鉴别分子内羧基的存在,据此填表;
所含官能团为酚羟基、碳碳双键和羧基,①羧酸是有机酸,其酸性强于碳酸,可与碳酸氢钠反应生成二氧化碳,因此碳酸氢钠可用于鉴别分子内羧基的存在,据此填表;
②羟基对苯环产生影响,是连接羟基的苯环上的邻对位较为活跃,可与浓溴水发生取代反应。
(1)因反应后生成溴化钠,为了证明上层溶液中是否含有溴离子,可向溶液C中加入足量稀HNO3调至酸性,再加入AgNO3溶液,若有浅黄色沉淀生成,则根据元素守恒可知,原溴乙烷中存在溴原子,
故答案为:加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成;
溴乙烷与氢氧化钠水溶液在加热的条件下会发生水解反应生成乙醇与溴化钠,其化学方程式为:CH3CH2Br + NaOH![]() CH3CH2OH + NaBr,
CH3CH2OH + NaBr,
故答案为:CH3CH2Br + NaOH![]() CH3CH2OH + NaBr;
CH3CH2OH + NaBr;
(2)①—COOH可与碳酸氢钠反应生成二氧化碳,产生无色气泡,而酚羟基不能,故可用碳酸氢钠检验该有机物中是否含—COOH,其化学方程式为:![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O,
+ CO2↑+ H2O,
故答案为:![]() + NaHCO3
+ NaHCO3![]()
![]() + CO2↑+ H2O。
+ CO2↑+ H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
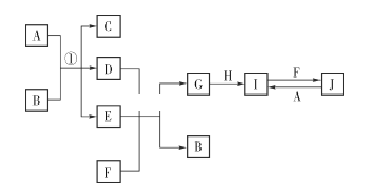
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向NH4HSO4溶液中加入少量NaOH稀溶液:NH4++OH-=NH3·H2O
B.Cl2通入氢碘酸溶液中:Cl2+2HI=I2+2H++2Cl-
C.向Ca(ClO)2溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3-
D.NO2通入AgNO3溶液中:3NO2+H2O=2NO3-+NO+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究甲烷与氯气的取代反应,装置、现象如下:
现象 |
ⅰ.光照后,产生白雾,混合气体颜色变浅 ⅱ.试管内液面上升至试管的2/3;试管壁和液面上出现少量油状液滴 |

下列说法不正确的是
A. 饱和食盐水可以减少氯气的溶解
B. 油状液滴的主要成分是一氯甲烷
C. 产生白雾以及试管内液面上升证明有氯化氢生成
D. 为了探究反应条件,可用黑色纸套套住装满甲烷和氯气的试管,一段时间后进行观察
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有K+、Cl-、OH-、SO32-、SO42-,为检验溶液中所含的某些阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法省略,检验其他阴离子的过程如下图所示。

(1)图中试剂①~⑤溶质的化学式分别是:
①________,②________,③________,④__________,⑤__________。
(2)图中现象c表明检验出的离子是________________。
(3)白色沉淀A若加试剂③而不加试剂②,对实验的影响是____________________。
(4)气体E通入试剂④发生反应的离子方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】EPR橡胶(聚乙丙烯)和工程材料聚碳酸酯(简称PC)的一种合成路线如下:

已知:酯与含羟基的化合物可发生如下酯交换反应:RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
请回答:
(1)D中所含的官能团是_______。
(2)EPR橡胶的结构简式_______。
(3)下列说法正确的是_______(填字母)。
a.反应③的原子利用率为100%
b.反应④为取代反应
c.1mol F与足量金属Na反应,最多可生成22.4L H2(标准状况下)
(4)反应②的化学方程式是_______。
(5)反应②生成E时会产生多种副产物,其中有一种分子式为C9H12O2的副产物M,其结构简式为_______。
(6)反应⑤的化学方程式是_______。
(7)已知: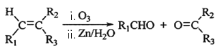 (R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
(R1、R2、R3代表烃基)写出以D为原料合成己二酸[HOOC(CH2)4COOH]的合成路线,无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件_______________________。
示例:CH3CH2OH![]() CH2=CH2
CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.分子式为C4H10O的有机化合物一定是饱和一元醇
B.1molCl2通入足量水充分反应后转移的电子数为6.02×1023
C.H2O2具有氧化性,该性质可用于与酸性高锰酸钾溶液反应制取少量氧气
D.已知胆矾溶于水时溶液温度降低,胆矾分解的热化学方程式为CuSO45H2O(s)═CuSO4(s)+5H2O(l) △H=+Q1 kJmol-1.室温下,若1mol无水硫酸铜溶解为溶液放热Q2 kJ,则Q1>Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知甲烷的燃烧热为890.3kJmol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJmol-1
B. 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C. 已知中和热为△H=-57.4kJmol-1,则1mol稀硫酸和足量稀NaOH溶液反应的反应热就是中和热
D. 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理废催化剂FeBr3溶液,得到溴的苯溶液和无水FeCl3。下列设计能达到相应实验目的的是
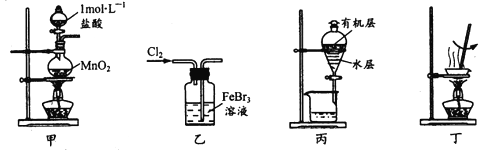
A. 用装置甲制取氯气
B. 用装置乙使Br- 全部转化为溴单质
C. 用装置丙分液时先从下口放出水层,再从上口倒出有机层
D. 用装置丁将分液后的水层蒸发至干,再灼烧制得无水FeCl3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com