
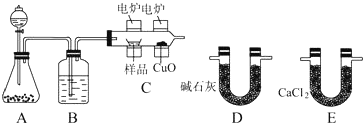
分析 实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式.因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用于制备氧气、B为干燥装置、C是在电炉加热时用纯氧气氧化管内样品,根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,D吸收二氧化碳、E用于吸收水,确定物质的化学式可借助元素的质量守恒进行解答,以此解答该题.
解答 解:(1)A为固体和液体反应制备氧气的装置,可用过氧化氢和二氧化锰,也可用过氧化钠和水反应制备,方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑(或2Na2O2+2H2O=4NaOH+O2↑),
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑(或2Na2O2+2H2O=4NaOH+O2↑);
(2)由以上分析可知B用于吸收氧气中的水蒸气(或干燥氧气),CuO的作用是使有机物充分氧化生成CO2和H2O,
故答案为:吸收氧气中的水蒸气(或干燥氧气); 使有机物不完全燃烧的产物全部转化为CO2和H2O;
(3)有机物燃烧生成水和二氧化碳,应先用氯化钙吸收水,然后再用碱石灰吸收二氧化碳,故答案为:E;D;
(4)如用二氧化锰和过氧化氢制备氧气,则固体为二氧化锰,不溶于水,可用过滤的方法分离,如用过氧化钠和水制备氧气,生成氢氧化钠,可用蒸发结晶的方法制备,
故答案为:过滤〔蒸发结晶(需与Na 2O 2跟H 2O反应制O 2相对应)〕;
(5)D管质量增加2.64g克说明生成了2.64g,n(CO2)=$\frac{2.64g}{44g/mol}$=0.06mol,m(C)=0.06mol×12g/mol=0.72g;
E管质量增加1.08g,说明生成了1.08g的水,n(H2O)=$\frac{1.08g}{18g/mol}$=0.06mol,m(H)=0.06mol×2×1g/mol=0.12g;
从而可推出含氧元素的质量为:1.8g-0.72g-0.12g=0.96g,n(O)=$\frac{0.96g}{16g/mol}$=0.06mol,
N(C):N(H):N(O)=0.06mol:0.12mol:0.06mol=1:2:1,
故该有机物的实验式为CH2O,式量为30,
该有机物的相对分子质量为:45×2=90,设分子式为 CnH2nOn,30n=90,解得n=3,故分子式为:C3H6O3;
因 1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1:1,则含一个羟基和一个羧基,
故该有机物结构简式为:CH3CH(OH)-COOH、HO-CH2CH2-COOH;
故答案为:CH2O;C3H6O3;CH3CH(OH)-COOH、HO-CH2CH2-COOH.
点评 本题有机物的推断、物质的分子的测定,侧重于学生的分析、实验和计算能力的考查,为高频考点,题目有利于培养学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:推断题
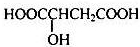 、P:
、P: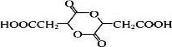 、E:HOOCC≡CCOOH、S:
、E:HOOCC≡CCOOH、S: .
. .
.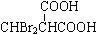
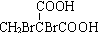 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 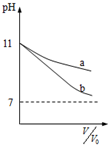 图可表示体积均为V0L、pH均为11的氨水与NaOH溶液分别用水稀释至VL情况,则b曲线为氨水 | |
| B. | 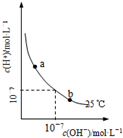 图可表示水溶液中H+与OH-的浓度变化曲线,则升高温度可实现a→b | |
| C. | 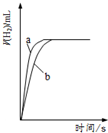 图可表示体积均为100mL、pH均为3的盐酸与醋酸,分别与0.003gZn反应,则a表示盐酸 | |
| D. | 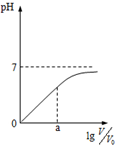 图可表示体积为V0L1 mol•L-1盐酸用水稀释至VL情况,则0~a范围内:pH=lg$\frac{V}{{V}_{0}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | WX2是生产光导纤维的原料 | |
| B. | RX2可用作自来水的消毒剂 | |
| C. | 工业上获得单质Y是用氢气热还原YR得到 | |
| D. | Y、Z、R的最高价氧化物的水化物两两之间均能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内的压强不随时间变化 | |
| B. | A、B、C的浓度不再变化 | |
| C. | 单位时间内生成n mol A,同时消耗2n mol C | |
| D. | A、B、C的分子数之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌是负极,电子流向为“锌片→LED灯→铜片→稀H2SO4→锌片” | |
| B. | 氢离子在铜片表面被还原 | |
| C. | 如果将硫酸换成橙汁,LED 灯不能发光 | |
| D. | 该电源工作时,烧杯中阳离子向Zn极移动,且c(H+)减小,c(Cu2+)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绝大多数金属的冶炼主要依据氧化还原反应原理 | |
| B. | 工业上可利用铝热反应炼铁 | |
| C. | 金属铝的冶炼可采取电解熔融氯化铝的方法 | |
| D. | 金属冶炼常会消耗许多能量,也易造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
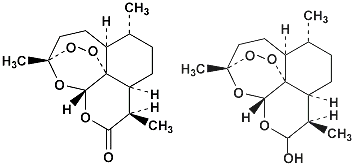
| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 由青蒿素制备双氢青蒿素的反应属还原反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
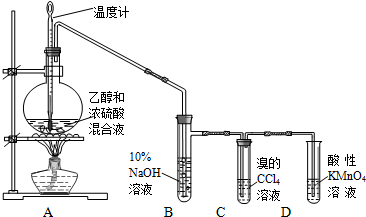 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图.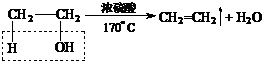 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com