
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24。则下列判断正确的是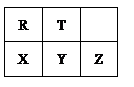
| A.R位于元素周期表中第二周期第IVA族 |
| B.五种元素中原子半径最大的是X |
| C.气态氢化物稳定性:Y>T |
| D.Z元素的最高价氧化物对应的水化物的化学式为HZO4 |
AB
解析试题分析:根据元素周期表的相对位置,R与X同主族和T与Y同主族,结合它们的最外层电子数之和为24。设R的最外层电子为x,则2x+2x+2+x+2=24,x=4,可知R为C,X为Si,T为N,Y为P,Z为S。A、C位于元素周期表中第二周期第IVA族,A正确;B、同周期从左至右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,五种元素中原子半径最大的是X(Si),B正确;C、同主族从上到下,非金属逐渐减弱,金属性逐渐增强,非金属越强,气态氢化物的稳定性越强,气态氢化物稳定性:T>Y,C错误;D、Z元素的最高价氧化物对应的水化物的化学式为H2ZO4(H2SO4),D错误。
考点:考查元素周期表与元素周期律。


科目:高中化学 来源: 题型:单选题
某短周期金属元素原子核外最外层电子数是最内层电子数的1.5倍,下列说法正确的是( )
| A.该元素的单质性质活泼,具有较强的还原性,可以用于某些金属冶炼 |
| B.该元素的单质常温下不与浓硫酸反应 |
| C.该元素的单质无需特别保存,因为其性质稳定,不易与空气中的成分反应 |
| D.该元素的最高价氧化物对应的水化物只能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知短周期元素甲、乙、丙、丁、戊的原子序数依次增大,其氢化物中甲、乙、丙、丁、戊的化合价如下,下列说法正确的是( )
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是( )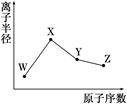
| A.化合物XZW既含离子键也含共价键 |
| B.对应气态氢化物的稳定性Y>Z |
| C.对应简单离子半径:X>W |
| D.Y的氧化物能与Z或X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于指定粒子构成的叙述中,不正确的是 ( )。
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素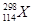 与 与 具有相同的最外层电子数 具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
| D.O22-与S2-具有相同的质子数和电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、W、Q是原子序数依次增大的5种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是( )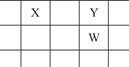
| A.5种元素中,原子半径最大的是W |
| B.Y与Z形成的化合物都可以和盐酸反应 |
| C.Y的简单阴离子比W的简单阴离子还原性强 |
| D.Z与Q形成的化合物水溶液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z分别是短周期元素的三种单质,它们都是常见的金属或非金属。M、N、R是常见的三种氧化物。其中一种具有高熔点,而且有如下反应(条件未标出,方程未配平):
(1)X+Z→N;
(2)M+X→N;
(3)M+Y→R+X。
若X是非金属,则组成Y单质的元素在周期表中的位置是( )
| A.第二周期ⅣA族 | B.第二周期ⅥA族 |
| C.第三周期ⅡA族 | D.第三周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是( )
| A.Z元素的原子半径可能比Y元素的小 |
| B.W的原子序数可能是Y的原子序数的2倍 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的化学活泼性一定比X强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列判断中一定正确的是( )
| A.若A2+2D-=2A-+D2,则还原性:D->A- |
| B.若R2+和M+的电子层结构相同,则碱性:ROH>MOH |
| C.若X2、Y2都是气态单质,且酸性HX>HY,则非金属性X>Y |
| D.若M、N是同主族元素,且原子序数:M>N,则非金属性:M>N |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com