
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A.向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明氯水的氧化性强于I2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性
C.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣
D.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届内蒙古巴彦淖尔市高三上期中考试理化学试卷(解析版) 题型:选择题
通过资源化利用的方式将CO2转化为具有工业应用价值的产品(如图所示),是一种较为理想的减排方式,下列说法中正确的是( )

A.CO2经催化分解为C、CO、O2的反应为放热反应
B.除去Na2CO3固体中少量NaHCO3可用热分解的方法
C.过氧化尿素和SO2都能使品红溶液褪色,其原理相同
D.由CO2和H2合成甲醇,原子利用率达100%
查看答案和解析>>
科目:高中化学 来源:2015-2016北京大学附中宇华教育集团高一12月化学卷(解析版) 题型:选择题
在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A.v(A )=0.5mol•L﹣1.mim﹣1
)=0.5mol•L﹣1.mim﹣1
B.v( B)=0.3mol•L﹣1.mim﹣1
B)=0.3mol•L﹣1.mim﹣1
C.v(C)=0.8mol•L﹣1.mim﹣1
D.v(D)=1.0mol•L﹣1.mim﹣1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高二上二次月考化学试卷(解析版) 题型:选择题
常温下0.1 mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A.将溶液稀释到原体积的10倍 B.提高溶液的温度
C.加入等体积0.2 mol·L-1盐酸 D.加入适量的醋酸钠固体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁实验中学分校高一上12月月考化学卷(解析版) 题型:选择题
既能跟盐酸反应,又能跟氢氧化钠溶液反应的氢氧化物是
A.Al2O3 B.MgO C.NaHCO3 D.Al(OH)3
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附属中学高三上适应性月考理综化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】
在元素周期表中,除稀有气体外几乎所有元素都能与氢形成氢化物
(1)氨气是共价型氢化物。工业常用氨气和醋酸二氨合铜{[Cu(NH3)2]Ac}的混合液来吸收一氧化碳(醋酸根CH3COO?简写为Ac?)。反应方程式为:[Cu(NH3)2]Ac+ CO+NH3 [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
①请写出基态Cu原子的电子排布式 。
②氨水溶液中各元素原子的第一电离能从大到小排列顺序为 ,理由是 ;其中NH3应为 (填“极性”或“非极性”)分子。
③醋酸分子中的两个碳原子的化方式分别是 。
④生成物[Cu(NH3)3CO]Ac中所含化学键类型有 。(填序号)
a.离子键 b.金属键 c. 共价键 d. 配位键
(2)某离子型氢化物化学式为XY2,晶胞结构如下图所示,其中6个Y原子(○)用阿拉伯数字1~6标注。
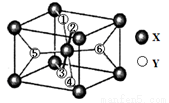
①已知1、2、3、4号Y原子在晶胞上、下面上。则5、6号Y原子均在晶胞 。(填“侧面”或“内部”)
②根据以上信息可以推知,XY2晶体的熔沸点 (填“>”“=”“<”)固态氨的沸点。
③若该晶胞的边长为a nm,密度为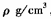 ,XY2的摩尔质量为
,XY2的摩尔质量为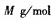 ,则阿伏加德罗常数可表示为
,则阿伏加德罗常数可表示为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上期中测试化学试卷(解析版) 题型:选择题
(改编)下列说法不正确的是
A.甲苯和环己烯都能使酸性高锰酸钾溶液褪色
B.用银氨溶液可以鉴别乙醛和葡萄糖溶液
C.甲醛和乙二醇都可作为合成高分子化合物的单体
D.丙烷和2-甲基丙烷的一氯代物均为两种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上12月月考化学试卷(解析版) 题型:填空题
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料:(以下数据和实验均指在25℃下测定)
难溶电解质 | CaCO3 | CaSO4 |
Ksp | 2.8×10-9 | 9×10-6 |
实验步骤如下:
①往100 mL 0.1 mol·L-1的CaCl2溶液中加入100 mL 0.1 mol·L-1的Na2SO4溶液,立即有白色沉淀生成。
②向上述悬浊液中加入足量Na2CO3 固体,搅拌,静置,沉淀后弃去上层清液.
③再加入蒸馏水搅拌,静置,沉淀后再弃去上层清液.
④________________________。
(1)步骤①所得悬浊液中c(Ca2+)=________ mol·L-1
(2)写出第②步发生反应的离子方程式:_______________________
(3)请补充第④步操作及发生的现象___________________________
(4)请写出该原理在实际生产生活中的一个应用________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二上学期期中(理)化学试卷(解析版) 题型:实验题
利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ/mol):_________ __________________。
(2)倒入NaOH溶液的正确操作是:____________。 (从下列选项中选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1) /℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH =__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)___________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com