
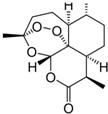
 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素的同分异构体可能有芳香族化合物 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素可用蒸馏水从植物提取 |
分析 A.根据结构简式确定分子式;
B.有机物含有5个环,1个C=O键,不饱和度为6,苯环的不饱和度是4;
C.青蒿素中含有酯基,具有酯的性质;
D.该有机物中不含亲水基,不易溶于水.
解答 解:A.根据结构简式确定分子式为C15H22O5,故A正确;
B.有机物含有5个环,1个C=O键,不饱和度为6,苯环的不饱和度是4,其同分异构体可能含有苯环,故B正确;
C.青蒿素中含有酯基,具有酯的性质,能和NaOH溶液发生水解反应,故C正确;
D.该有机物中不含亲水基,不易溶于水,所以不能用蒸馏水提取,青蒿素需用有机物石油醚从从植物提取,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断及知识运用能力,涉及同分异构体、结构简式确定、酯的性质等知识点,明确物质性质及结构关系是解本题关键,易错选项是B.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
| A. | c1=0.2 | |
| B. | 丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-) | |
| C. | a>9 | |
| D. | 在乙组混合液中由水电离出的c(OH-)=10-5mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯中的甲苯(溴水) | B. | 乙醇中的水(新制CaO) | ||
| C. | 乙醛中的乙酸(NaOH) | D. | 乙酸乙酯中的乙酸(饱和NaHCO3溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
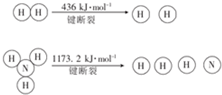
 .
.
| n(N2)/mol | N(H2)/mol | N(NH3)/mol | |
| 甲 | 1 | 3 | 0 |
| 乙 | 0.5 | 1.5 | 1 |
| 丙 | 0 | 0 | 4 |
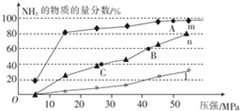
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.
已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.E是具有果香味的酯,F是一种高聚物,可制成多种包装材料.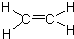 ,C的名称为乙醛.
,C的名称为乙醛.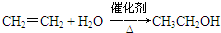 ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com