
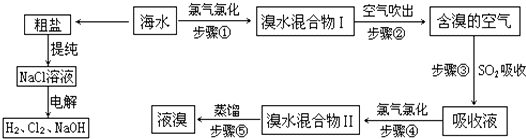
分析 海水通过蒸发结晶晒盐得到粗盐和母液,粗盐精制得到精盐溶解制备饱和溶液,通电电解得到氢氧化钠溶液、氯气、氢气,海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴,步骤①氯气和溴离子反应生成溴单质;步骤②通过热空气吹出后用二氧化硫吸收得到溴离子,步骤③通入二氧化硫,溴与二氧化硫水溶液反应生成硫酸和溴化氢,步骤④在氯水溶液中重新得到溴单质,富集溴元素,步骤⑤萃取蒸馏得到溴单质,据此回答.
(1)根据海水淡化的常见方法来回答;
(2)依据电离平衡常数比较碳酸酸性大于次氯酸,第一步电离大于次氯酸,第二步电离小于次氯酸的电离,结合84消毒液成分为次氯酸钠和二氧化碳反应生成的次氯酸见光分解分析;
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图.步骤①反应是氯气和溴离子反应生成溴单质;过程中得到溴单质,通过热空气吹出后用二氧化硫吸收得到溴离子,在氯水溶液中重新得到溴单质;步骤③通入二氧化硫富集溴元素;溴与二氧化硫水溶液反应生成硫酸和溴化氢;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发.
解答 解:(1)海水淡化的方法有:蒸馏法、电渗析法、离子交换法等,
故答案为:蒸馏法、电渗析法、离子交换法及其他合理答案中的任意两种;
(2)依据电离平衡常数比较碳酸酸性大于次氯酸,第一步电离大于次氯酸,第二步电离小于次氯酸的电离,结合84消毒液成分为次氯酸钠和二氧化碳反应生成的次氯酸见光分解分析可知;次氯酸钠和二氧化碳、水反应生成次氯酸和碳酸氢钠,次氯酸见光分解生成盐酸和氧气,反应的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-;
故答案为:ClO-+CO2+H2O=HClO+HCO3-;
(3)海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如上图.步骤①反应是氯气和溴离子反应生成溴单质,反应的离子方程式为:2Br-+Cl2=Br2+2Cl-;过程中得到溴单质,通过热空气吹出后用二氧化硫吸收得到溴离子,在氯水溶液中重新得到溴单质;步骤③通入二氧化硫富集溴元素;溴与二氧化硫水溶液反应生成硫酸和溴化氢,反应的化学方程式SO2+Br2+2H2O=2HBr+H2SO4,
故答案为:2Br-+Cl2=Br2+2Cl-;富集溴元素;SO2+Br2+2H2O=2HBr+H2SO4;
(4)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气会随溴排出,溴中水蒸气增加;温度过低,溴不能完全蒸出,产率低.
点评 本题考查了海水资源的利用分析判断,主要是流程操作的理解应用,掌握基础是关键,综合考查了学生运用知识分析问题和解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
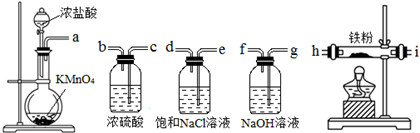
| A. | a-e-d-c-b-h-i-g | B. | a-d-e-c-b-h-i-g | C. | a-e-d-h-i-g-f-c | D. | a-b-c-d-e-f-g-h |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 11.7g | B. | 23.4 g | C. | 26.5g | D. | 58.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸的电离 | B. | Ba(OH)2•8H2O晶体与NH4Cl晶体反应 | ||
| C. | 焦炭与二氧化碳气体发生的反应 | D. | Na与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(SO2):澄清石灰水 | B. | CO2(CO):通入氧气,并加热 | ||
| C. | Cl2(HCl):饱和碳酸钠溶液 | D. | Fe(Al):烧碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com