
【题目】反应4NH3(g)+5O2(g)═4NO(g)+6H2O(g) 在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则平均每秒钟各物质浓度变化正确的是( )
A.NH3:0.002 molL﹣1
B.H2O:0.002 molL﹣1
C.NO:0.001 molL﹣1
D.O2:0.001 molL﹣1
【答案】C
【解析】解:A.在2L的密闭容器中进行,1分钟后,NH3减少了0.12mol,则△c(NH3)= ![]() =0.06mol/L,V(NH3)=V=
=0.06mol/L,V(NH3)=V= ![]() =
= ![]() =
= ![]() =0.001mol(Ls)﹣1 , 则平均每秒钟NH3浓度变化为0.001mol/L,故A错误;
=0.001mol(Ls)﹣1 , 则平均每秒钟NH3浓度变化为0.001mol/L,故A错误;
B.平均每秒钟H2O浓度变化△c(H2O)= ![]() △c(NH3)=0.001mol/L×
△c(NH3)=0.001mol/L× ![]() =0.0015mol/L,故B错误;
=0.0015mol/L,故B错误;
C.平均每秒钟NO浓度变化△c(NO)=△c(NH3)=0.001mol/L,故C正确;
D.平均每秒钟O2浓度变化△c(O2)= ![]() △c(NH3)=0.001mol/L×
△c(NH3)=0.001mol/L× ![]() =0.00125 mol/L,故D错误;
=0.00125 mol/L,故D错误;
故选C.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组模拟呼吸面具中的原理(过氧化钠与潮湿二氧化碳反应),设计用下图所示的仪器来制取氧气并测量氧气的体积。图中E为量气装置。

本实验可供选用的药品还有:稀硫酸、稀盐酸、过氧化钠、大理石、水。
试回答:
(1)图中装置的连接顺序是(填装置的字母编号),其中连接胶管及支持装置省略:_________。
(2)装置C中放入的反应物是________和_________________。(写化学式)
(3)装置A的作用是__________________;装置B的作用是_______________。
(4)装置D中发生的化学反应方程式为__________________________。
(5)为了较准确地测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数求其差值的过程中,应注意_____________。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数。
c.读数时应上下移动乙管,使甲、乙两管液面相平。
d.读数时不一定使甲、乙两管液面相平。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法正确的是( )

A. Mg和Al的总质量为8g B. 硫酸的物质的量浓度为5mol/L
C. NaOH溶液的物质的量浓度为5mol/L D. 生成的H2在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取100 mL的Na2CO3和Na2SO4混合溶液,加入适量Ba(OH)2溶液100 mL后,恰好完全反应,过滤、干燥后得到14.51 g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后减少到4.66 g,并有气体放出.计算:
(1)原混合液中Na2SO4的物质的量浓度为________mol·L-1;
(2)产生的气体在标准状况下的体积为________L;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(设反应前后溶液的密度均为1 g·cm-3,反应前后溶液体积变化忽略不计)___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定温度一定的密闭容器中发生反应M2(?)+2R2(g)M2R4(g),加入1mol M2和2molR2 , 反应过程中测得气体的平均相对分子质量随时间的变化如图所示.则下列说法错误的是( ) 
A.M2既可能为固体,也可能为气体
B.达到平衡后,保持容器容枳和温度不变,再加入1molM2和2molR2 , 则R2转化率不变
C.达到平衡后,保持温度不变,将容器容积压缩到原来的一半,当达到新的平衡时,R2的浓度可能是原平衡时的1.8倍
D.若M2为气体,达到平衡后,保持容器容积和温度不变,再加入1molM2R4 , 则新的平衡时气体的平均相对分子质量增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( ) 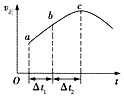
A.反应物的总能量低于生成物的总能量
B.△t1=△t2时,CO的转化率:a~b段小于bc段
C.反应在c点达到平衡状态
D.反应物浓度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取25.0gCuSO45H2O晶体,加热使之均匀、缓慢升温至1000℃并恒温1小时,试通过计算回答下列问题(如果是混合物,要算出混合物中各组分的质量):
(1)在某中间温度时,固体产物质量是否可能为10g?
(2)不考虑实验带来的误差,在反应条件下,反应气态产物除去水后,物质的量可能为
A.0mol
B.0.1mol
C.大于0.1mol
(3)你认为最终固体产物为多少克?产物颜色如何?
(4)如果某同学做此实验时最后固体质量为7.6g,试计算其组分.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,HCl作还原剂的是( )
A. NaOH + HCl = NaCl + H2O
B. Zn + 2HCl = ZnCl2 + H2↑
C. MnO2 + 4HCl(浓)![]() MnCl2 + 2H2O + Cl2↑
MnCl2 + 2H2O + Cl2↑
D. CuO + 2HCl = CuCl2 + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com