
【题目】海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示:
![]()
回答下列问题:
<span style="font-size: 14px; font-family: "Times New Roman";"><span contenteditable="true">(1)</span></span>写出在海水中加入氧化钙生成氢氧化镁的化学方程式_______________________。操作①的名称________。
(2)加入试剂①,反应的离子方程式为___________________。
(3)操作②的名称__________。
(4)经操作③最终可得金属镁,该反应的化学方程式是________________。
【答案】 CaO+H2O+MgCl2==CaCl2+Mg(OH)2↓ 过滤 Mg(OH)2+2H+=Mg2++2H2O 蒸发结晶 MgCl2![]() Mg+Cl2↑
Mg+Cl2↑
【解析】从海水中提取金属镁的流程:把贝壳制成石灰乳操作①;在引入的海水中加入石灰乳,将海水中含有的镁离子转化为氢氧化镁沉淀,反应方程式为:Mg2++2OH-=Mg(OH)2 ↓;然后将氢氧化镁溶于盐酸中操作②得到氯化镁溶液,反应方程式为:Mg(OH)2 +2HCl=MgCl2+2H2O,用氯化镁溶液在氯化氢氛围中制取无水氯化镁;活泼金属采用电解其熔融盐的方法冶炼,镁是活泼金属,最后利用电解熔融氯化镁的方法冶炼镁操作③,反应方程式为MgCl2![]() Mg+Cl2↑.
Mg+Cl2↑.
(1)在海水中加入氧化钙发生反应:CaO+H2O═Ca(OH)2 ;氢氧化钙和海水中的氯化镁发生复分解反应:MgCl2+Ca(OH)2 ═Mg(OH)2 ↓+CaCl2,所以在海水中加入氧化钙生成氢氧化镁的化学方程式为:CaO+H2O+MgCl2═CaCl2+Mg(OH)2 ↓,氢氧化镁是难溶性的固体,将不溶性的固体和溶液分离的方法是过滤,所以操作①主要是指过滤;(2)将氢氧化镁溶于盐酸中得到氯化镁溶液,不引入其它杂质阴离子,所以试剂①为盐酸,反应为:Mg(OH)2 +2H+═Mg2++2H2O; (3)从溶液中析出固体采用蒸发结晶的方法;(4)镁是活泼金属,工业上采用电解氯化镁的方法冶炼镁,其电解反应方程式为:MgCl2(熔融)![]() Mg+Cl2↑。
Mg+Cl2↑。
点睛: 本题考查了镁的提取,掌握从海水中提取金属镁的流程:先将海水中含有的镁离子转化为氢氧化镁沉淀,然后将氢氧化镁溶于盐酸中得到氯化镁溶液,用氯化镁溶液制取无水氯化镁,最后利用电解熔融氯化镁的方法冶炼镁,是解答的关键,题目难度中等。


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
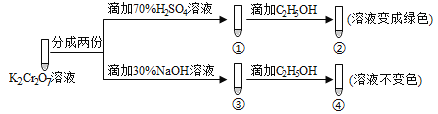
结合实验,下列说法正确的是
A. ①中溶液变黄,③中溶液橙色加深
B. 上述可逆反应的平衡常数:①<③
C. K2Cr2O7溶液的氧化性在酸性条件下更强
D. 若向④中加入70%H2S04溶液至过量,溶液变为橙色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从人类健康或生活实际的角度考虑,下列叙述不正确的是( )
A.常用铁锅炒菜比常用铝锅好
B.氯气泄漏后应顺风向低处跑
C.用Na2O2做呼吸面具的供氧剂
D.食用“加碘”食盐有利于健康
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列7种物质:
①白磷(P4) ②水晶 ③氯化铵 ④氢氧化钙 ⑤氟化钠 ⑥过氧化钠 ⑦干冰
固态时都为晶体,其中既有范德华力,又有非极性键的晶体是 (填写序号,下同),只存在离子键的是 ,熔化时只破坏共价键的是 。
(2)下图是XeF4的结构示意图,据此判断XeF4是 (填“极性”、“非极性”)分子。
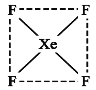
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年10月,我国著名药学家屠呦呦因发现治疗疟疾新型药物青蒿素和双氢靑蒿素而获得2015年诺贝尔生理学或医学奖,成为首位获得诺贝尔科学奖的华人女科学家,震惊世界,感动中国。青蒿素(C15H22O5)的结构如图甲所示。请回答下列问题:
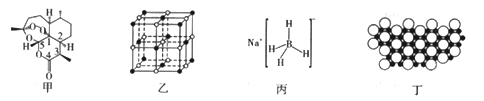
(1)组成靑蒿素的三种元素电负性由大到小的顺序是_________;在基态O原子中,核外存在________对自旋方向相反的电子。
(2)下列关于青蒿素的说法正确的是_______(填序号)。
a.青蒿素中既存在极性键又存在非极性键
b.在青蒿素分子中,所有碳原子均处于同一平面
c.图中数字标识的五个碳原子均只以σ键与其他原子成键
(3)在确定青蒿素结构的过程中,可采用硼氢化钠(NaBH4)作为还原剂,其制备方法为4NaH+ B(OCH3)3![]() NaBH4+3CH3ONa。
NaBH4+3CH3ONa。
①NaH为______晶体,图乙是NaH晶胞结构,则NaH晶体的配位数是______;若晶胞棱长为a,则Na原子间最小核间距为_______。
②B(OCH3)3中B采用的杂化类型是__________。写出一种与B(OCH3)3具有相同空间构型的分子或离子:______________________。
③NaBH4结构如图丙所示,结构中存在的作用力有__________。NaBH4是有机化学中的一种常用还原剂,其在热水中水解生成偏硼酸钠和氢气,该反应的化学方程式为______________。
(4)硼(B)及其化合物在化学中有重要的地位。科学家发现硼化镁在39k时呈超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图丁是该晶体微观空间中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同—平面上。根据图示确定硼化镁的化学式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙烯、氯乙烯、聚氯乙烯均能使溴水褪色
B. 间二甲苯只有一种结构,说明苯不是单双键交替的结构
C. 等物质的量的乙烯和乙醇完全燃烧,乙烯消耗的氧气多
D. 煤的气化就是把煤转化为可燃性气体的过程,该气体可用来合成液态烃及甲醇等含氧有机物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com