


| c(SO42-) |
| c(CO32-) |
| c(SO42-)c(Ca2+) |
| c(CO32-)c(Ca2+) |
| Ksp(CaSO4) |
| Ksp(CaCO3) |
| 7.5×10-5 |
| 3.0×10-9 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
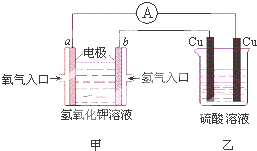 根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )
根据如图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是( )| A、利用该反应可持续产生硫酸铜直至硫酸耗尽 | ||||
| B、甲中a电极的电极反应为:O2+4H++4e-=2H2O | ||||
C、装置开始工作初期乙中的总反应为:Cu+H2SO4
| ||||
| D、反应过程中甲、乙装置中溶液的pH都逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5mol/L |
| B、6.25mol/L |
| C、6.5mol/L |
| D、8.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16g14CH4所含中子数目为8NA |
| B、1 mol-CH3含有9 NA个电子 |
| C、常温常压下,44 g CO2气体含有氧原子的个数为2 NA |
| D、46gNO2和N2O4的混合物含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、40% |
| C、50% | D、60% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氯甲烷有两种同分异构体 |
| B、丙烷的二氯代物有四种同分异构体,则其六氯代物也有四种同分异构体 |
| C、(CH3CH2)2CHCH3一氯取代物有两种同分异构体 |
| D、烷烃失去一个氢原子剩余的原子团叫烷基,苯环上的氢原子被烷基取代后、和苯分子相差若干CH2的物质是苯的同系物,则苯的同系物C8H10有三种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
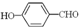 的沸点比
的沸点比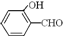 高,原因是
高,原因是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体均为无色透明的液体 |
| B、利用丁达尔效应可以区分胶体和溶液 |
| C、胶体中分散质粒子的直径在1~100 nm之间 |
| D、向沸水中逐滴加入少量FeCl3饱和溶液,可制得Fe(OH)3胶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com