
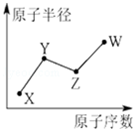
 U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示: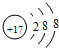 ;
;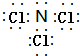 ;
;分析 Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成离子型晶体的一种盐,则Y为N元素;Z是地壳中含量最多的元素,则Z是O元素;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,且原子半径小于N,故X为H元素;U原子最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故U为C元素;V为原子核内有12个中子的二价金属,令其相对分子质量为a,根据电子转移守恒,则:$\frac{2.4}{a}$×2=$\frac{2.24}{22.4}$×2,解得=24,则V的质子数为24-12=12,故V为Mg.
解答 解:Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成离子型晶体的一种盐,则Y为N元素;Z是地壳中含量最多的元素,则Z是O元素;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,且原子半径小于N,故X为H元素;U原子最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故U为C元素;V为原子核内有12个中子的二价金属,令其相对分子质量为a,根据电子转移守恒,则:$\frac{2.4}{a}$×2=$\frac{2.24}{22.4}$×2,解得=24,则V的质子数为24-12=12,故V为Mg.
(1)Y为N元素,在周期表中的位置:第二周期ⅤA族,故答案为:第二周期ⅤA族;
(2)W的简单离子为Cl-,Cl-的结构示意图为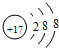 ,故答案为:
,故答案为: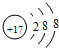 ;
;
(3)氢化物稳定性与元素非金属性一致,非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,故答案为:HF>HCl>H2S;
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,该化合物为NCl3,该化合物的电子式为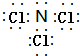 ,故答案为:
,故答案为: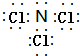 ;
;
(5)UZ2为CO2,结构式为O=C=O,故答案为:O=C=O;
(6)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,该物质为NH4NO3,含有离子键、共价键,故答案为:离子键、共价键;
(7)V与W两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4,二者反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O.
点评 本题考查位置结构性质关系等,难度中等,推断元素是解题的关键,注意对元素周期律的理解与运用,熟练掌握元素化合物知识.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | HCN的电离方程式:HCN?H++CN- | |
| B. | NaCN是一种弱电解质 | |
| C. | NaCN溶液中一定存在:c(Na+)>c(CN-) | |
| D. | 0.1mol•L-1NaCN溶液中:c(CN-)+c(HCN)=0.1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用作净水剂 | |
| B. | 酒精可用于杀菌、消毒 | |
| C. | 碳酸钙是陶瓷文物的主要成分 | |
| D. | 小苏打是一种膨松剂,可用于制作馒头和面包 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 太阳能不能直接转化为电能 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能等为人类所用 | |
| D. | 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
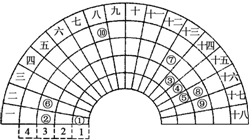 元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )
元素周期表的形式多种多样,下图是扇形元素周期表前四周期的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法正确的是( )| A. | ②、⑧、⑨对应原子半径依次增大 | |
| B. | ②、⑨的氢化物晶体类型相同 | |
| C. | 元素⑩处于常见周期表第四周期第VIIIB族 | |
| D. | ①、③、④、⑤形成的某种化合物中既含有共价键又含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.
短周期元素A、B、C、D、E原子序数依次增大.A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数.| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com