
铅蓄电池是最常用的化学电源,它在放电、充电时的电池反应为:
试回答:
(1)铅蓄电池负极的电极材料是_______。
(2)工作时铅蓄电池正极的电极反应是___________。
(3)铅蓄电池工作过程中,电解质溶液的密度会_______(填“减小”“增大”或“不变”,下同),pH________。
(4)该铅蓄电池在充电时阳极的电极反应是___________。
(5)如果用铅蓄电池做电源电解饱和食盐水制取Cl2,已知某铅蓄电池中硫酸溶液的体积为0.8L,电解前硫酸溶液浓度为4.5mol.L-1,当制得26.88LCl2时(指在标准状况下),求理论上电解后电池中硫酸溶液的浓度为(假设电解前后硫酸溶液的体积不变)________ mol.L-1。
(1)Pb (或铅)
(2)PbO2+4H++SO42-+2e-= PbSO4+2H2O
(3)减小、增大
(4)PbSO4+2H2O—2e-= PbO2+4H++SO42-
(5)1.5mol.L-1
解析试题分析:(1)铅蓄电池负极是失电子的一极,正极是得电子的一极,根据原电池总反应可判断其电极材料是Pb (或铅)。
(2)电池正极的电极反应是PbO2+4H++SO42-+2e-= PbSO4+2H2O 。
(3)根据总电极反应,由于硫酸溶液浓度减小,故电解质溶液的密度会减小。pH_增大。
(4)该铅蓄电池在充电时外界电源与原电池的正极相连,阳极的电极发生的反应氧化反应即失电子,电极反应为PbSO4+2H2O—2e-= PbO2+4H++SO42- 。
(5)电解前铅蓄电池中硫酸溶液的物质的量为3.6mol.,26.88LCl2时(指在标准状况下)物质的量为1.2mol,转移电子的物质的量是2.4mol。根据电子守恒,消耗硫酸2.4mol,硫酸还剩下1.2mol,因此电解后电池中硫酸溶液的浓度为1.2/0.8="1.5" mol.L-1。
考点:本题考查了电化学原理及其运用。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(1)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2该电池反应的化学方程式是________。
(2)化学在环境保护中起着十分重要的作用,催化反硝化学法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示。
①电源正极为__________(填A或B),阴极反应式为________________________。
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(Δm左-Δm右)为__________克。
(3)能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是_________________________________________________________________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在所给的材料中应选__________作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是 (填序号)。
| A.NiO2 | B.Fe | C.Fe(OH)2 | D.Ni(OH)2 |
 g M,则金属M的相对原子质量为 (用含“
g M,则金属M的相对原子质量为 (用含“ 、x”的表达式表示)。
、x”的表达式表示)。查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO3-、SO42-、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8克。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的 极(填写“正”或“负”),甲、乙两个烧杯中的电解质分别为 、 (填写化学式)。
(2)计算电极f上生成的气体在标准状况下体积为 L。
(3)写出乙烧杯中的电解反应方程式: 。
(4)若电解后甲溶液的体积为10L,则该溶液的pH为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
新型锂离子电池在新能源的开发中占有重要地位。可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)是新型锂离子电池的首选电极材料,它的制备方法如下:
方法一:将碳酸锂、乙酸亚铁[(CH3COO) Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
Fe]、磷酸二氢铵按一定比例混合、充分研磨后,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂,同时生成的乙酸及其它产物均以气体逸出。
方法二:将一定浓度的磷酸二氢铵、氯化锂混合溶液作为电解液,以铁棒为阳极,石墨为阴极,电解析出磷酸亚铁锂沉淀。沉淀经过滤、洗涤、干燥,在800℃左右、惰性气体氛围中煅烧制得晶态磷酸亚铁锂。
在锂离子电池中,需要一种有机聚合物作为正负极之间锂离子迁移的介质,该有机聚合物的单体之一(用M表示)的结构简式如下:
请回答下列问题:
(1)上述两种方法制备磷酸亚铁锂的过程都必须在惰性气体氛围中进行。其原因是 。
(2)在方法一所发生的反应中, 除生成磷酸亚铁锂、乙酸外, 还有 、 、 (填化学式)生成。
(3)在方法二中,阳极生成磷酸亚铁锂的电极反应式为 。
(4)写出M与足量氢氧化钠溶液反应的化学方程式: 。
(5)已知该锂离子电池在充电过程中,阳极的磷酸亚铁锂生成磷酸铁,则该电池放电时正极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)为了降低某水库的铁闸门被腐蚀的速率,可以采用图甲所示的方案,其中焊接在铁闸门上的固体材料R可以采用________(填字母)。
| A.铜 | B.钠 |
| C.锌 | D.石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某物质A的产量可以用来衡量一个国家的石油化工发展水平。其 与水加成的产物B是一种常用的有机溶剂,在生活中有重要的应用。
(1)A的电子式为________,B的分子式为________。
若用B与O2制成燃料电池,并以稀硫酸溶液为电解质溶液,回答(2)-(5)题:
(2)负极上的电极反应式为_______________________________________。
(3)消耗标准状况下的5.6 L O2时,有__________mol电子发生转移。
(4)开始放电时,正极附近溶液的pH__________(填“增大”、“减小”或“不变”);
(5)溶液中H+由___________区向__________区移动(填“正极”或“负极”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某课外兴趣小组用下图装置进行实验,试回答:
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚( )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。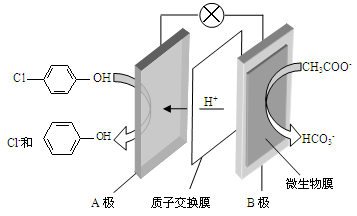
①B是电池的 极(填“正”或“负”);②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。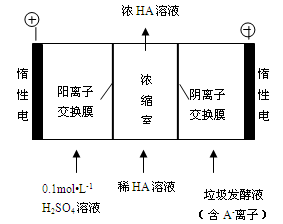
①阳极的电极反应式为 。
②简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com