
 乙二酸俗名草酸,下面是甲、乙两个化学学习小组的同学对草酸晶体(H2C2O4?xH2O)和草酸(H2C2O4)分别进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
乙二酸俗名草酸,下面是甲、乙两个化学学习小组的同学对草酸晶体(H2C2O4?xH2O)和草酸(H2C2O4)分别进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.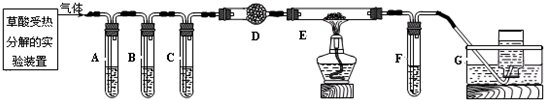


科目:高中化学 来源: 题型:

| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的同学,为测定某不同品牌铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.填写下列空白.| 盐酸 |
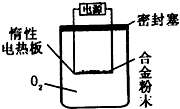
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、美丽的“水立方”是北京奥运会游泳馆,设计灵感来自于有机细胞的天然图案以及肥皂泡的形成.在这个中心的蓝色泡墙之内,钢结构的基本单位是一个由12个正五边形和2个正六边形组成的几何细胞,覆盖这个框架的是半透明的“气泡”,称为ETFE,该材料为四氟乙烯(CF2=CF2)与乙烯的共聚物,ETFE属于有机物中的烃类. |
| B、5月12日四川汶川发生特大地震,为防止在大灾之后疫病流行,全国各地向灾区运送了大量的各种消毒剂、漂白剂,如:Ca(ClO)2、ClO2、Al(OH)3等. |
| C、美国科学家马丁?查非(Martin Chalfie)、美国华裔化学家钱永健(Roger Tsien)以及日本科学家下村修(Osamu Shimomura)因发现和研究绿色荧光蛋白(green fluorescent protein,GFP)而获2008年度诺贝尔化学奖.向GFP中加入重金属离子,GFP就会变性. |
| D、神舟七号载人飞船于2008年9月25日21点10分发射升空.中国航天员首次空间出舱活动.“神舟七号”的燃料是氢化锂三兄弟--LiH、LiD、LiT.其中Li的质量数为7,这三种物质的化学性质不相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火时可用干粉灭火器扑灭 |
| B、在硫酸铜晶体结晶水含量测定的实验中,称量操作至少需要四次 |
| C、铜与浓硫酸反应时,用蘸有浓溴水的棉花放在导管口吸收多余的气体 |
| D、在250 mL烧杯中加入216 mL水和24 g NaOH固体,配制10%NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用过滤的方法分离在一定量苯酚溶液中加入足量浓溴水后的混合物 |
| B、用加热的方法提纯含有少量碳酸钠的碳酸氢钠固体 |
| C、用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡 |
| D、用盐析的方法分离、提纯蛋白质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com