
【题目】将铝、铁、铜粉的混合物,投入少量的盐酸中,充分反应后过滤,滤液中一定含有的物质是
A. FeCl3 B. CuCl2 C. AlCl3 D. FeCl2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】近年全国各地雾霾严重,为有效控制雾霾,各地积极采取措施改善大气质量。研究并有效控制空气中氮氧化物、碳氧化物等污染物是一项重要而艰巨的工作。
Ⅰ.氮氧化物的研究

(1)一定条件下,将2mol NO与2mol O2置于恒容密闭容器中发生反应:2NO(g)+O2(g) ![]() 2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
2NO2(g),下列状态能说明该反应达到化学平衡的是(_______)
A.混合气体的密度保持不变
B.NO的转化率保持不变
C.NO和O2的物质的量之比保持不变
D.O2的消耗速率和NO2的消耗速率相等
(2)已知反应. 2NO(g) ![]() N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
N2(g)+O2(g) ΔH<O,在不同条件时N2的体积分数随时间(t)的变化如图1所示。根据图象可以判断曲线R1、R2对应的下列反应条件中不同的是______ (填字母序号)。
A.压强 B.温度 C.催化剂
根据图2中的能量变化数据.计算反应2NO(g) ![]() N2(g)+O2(g)的ΔH=__________
N2(g)+O2(g)的ΔH=__________

Ⅱ.碳氧化物研究
(3)CO和H2在一定条件下可以合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:
CH3OH(g) ΔH<O ,现在体积为1L的恒容密闭容器(图3甲)中通入1mol CO和2mol H2,测定不同时间、不同温度(T)下容器中CO的物质的量,如下表:

请回答:
①T1_____ T2(填“>”或“<”或“=”),理由是____________________。已知T2℃时,第20min时容器内压强不再改变,此时H2的转化率为_________,该温度下的化学平衡常数为________ 。
②若将1mol CO和2mol H2通入原体积为1L的恒压密闭容器(图3乙)中,在T2℃下达到平衡,此时反应的平衡常数为_________;若再向容器中通入l mol CH3OH(g),重新达到平衡后,CH3OH(g)在体系中的百分含量_________(填“变大”或“变小”或“不变”)。
(4)一定条件下也可用NaOH溶液与CO反应生成甲酸钠,进一步反应生成甲酸来消除CO污染。常温下将a mol的CO通入2 L bmol/L NaOH 溶液中,恰好完全反应生成甲酸钠和含少量甲酸的混合溶液(假设溶液体积不变),测得溶液中c(Na+)=c(HCOO-),则该混合溶液中甲酸的电离平衡常数 Ka=____________ (用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列溶液的酸性最强的是( )
A.0.01 mol/L的HCl溶液B.pH=2的H2SO4溶液
C.c(OH-)=10-13 mol/L的溶液D.pH=1的HNO3溶液加水稀释为原来的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种烃,具有下列性质:
①各取0.1mol分别充分燃烧,其中B、C、E燃烧所得的CO2均为4.48L(标准状况),A和D燃烧所得的CO2都是前三者的3倍;
②在适宜条件下,A、B、C都能跟氢气发生加成反应,其中A可以转化为D、B可以转化为C,C可以转化为E;
③B和C都能使溴水或酸性KmnO4溶液褪色,而A、D、E无此性质;
④用铁屑作催化剂时,A可与溴发生取代反应.
判断A、B、C、D、E各是什么物质,写出结构简式ABCDE .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下反应最符合绿色化学原子经济性要求的是 ( )
A. 乙烯聚合为聚乙烯高分子材料
B. 甲烷与氯气制备一氯甲烷
C. 以铜和浓硝酸为原料生产硝酸铜
D. 乙醇氧化制备乙醛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.构成原电池正极和负极的材料必须是两种金属
B.由Cu、Zn作电极与CuSO4溶液组成的原电池中Cu是负极
C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被腐蚀
D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向l00 mL0.1 mol·L-1 硫酸铝铵[NH4A1(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。 随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
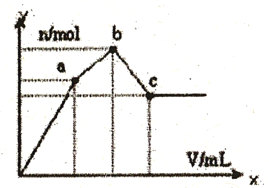
A. a点的溶液呈中性
B. c点溶液呈碱性
C. c点加入Ba(OH)2溶液的体积为200 mL
D. b 点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH-= Al(OH)3↓+2BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )。
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com