
【题目】2015年,我国科学家屠呦呦因发现青蒿素而荣获诺贝尔奖。由青蒿素合成衍生药物蒿甲醚的合成路线如下:下列说法正确的是( )
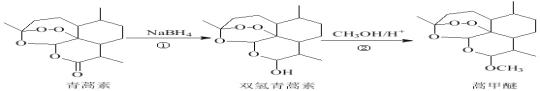
A.①、②反应依次为还原反应、取代反应
B.上述三种有机物的含氧官能团完全相同
C.青蒿素因含酯基具有氧化性和杀菌功能
D.蒿甲醚的化学式为C16H24O5
 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】有一种蓝色的晶体,它的结构特征是Fe2+和Fe3+分别占据立方体互不相邻的顶点,立方体的每个棱上均有一个CN-。
(1)根据晶体结构的特点,推出这种蓝色晶体的化学式(用简单整数表示)_____________。
(2)此化学式带何种电荷________,如用Rn+或Rn-与其结合成电中性粒子,此粒子的化学式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,参照元素在表中的位置,请用化学用语回答下列问题:
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
1 | ① | |||||||
2 | ⑤ | ⑥ | ⑦ | |||||
3 | ② | ③ | ④ | ⑧ | ||||
4 | ⑨ | |||||||
5 | ⑩ |
(1)元素⑥的名称为 ;⑨的最高价含氧酸的化学式为 。
(2)①和⑦两种元素的原子按1:1组成的常见化合物的结构式为 。
(3)③、④、⑦、⑧的简单离子半径由大到小的顺序为 。(用离子符号表示)
(4)②、④的最高价氧化物的水化物之间发生反应的离子方程式 。
(5)用电子式表示③和⑨组成的化合物的形成过程 。
(6)海带中含有⑩元素,海带灰中含有该元素的简单阴离子,在硫酸酸化下,可用双氧水将其氧化为单质。写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛被称为“二十一世纪金属”,工业上用钛铁矿制备金属钛的工艺流程如下:

已知:钛铁矿主要成分与浓硫酸反应的主要产物是TiOSO4和FeSO4,TiOSO4遇水会水解。
请回答下列问题:
(1)操作1用到的玻璃仪器除烧杯外还有 ,操作2是 、过滤,副产品主要成分的化学式为 。
(2)请结合化学用语解释将TiO2+转化为H2TiO3的原理 。
(3)已知钛的还原性介于铝与锌之间,估计钛能耐腐蚀的原因之一是 。如果可从Na、Zn、Fe三种金属中选一种金属代替流程中的镁,那么该金属跟四氯化钛反应的化学方程式是 。
(4)电解TiO2来获得Ti是以TiO2作阴极,石墨为阳极,熔融CaO为电解质,用碳块作电解槽,其阴极反应的电极反应式是 。
(5)为测定溶液中TiOSO4的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3TiO2+ +Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,向其中滴加2~3滴KSCN溶液作指示剂,用 (填一种玻璃仪器的名称)滴加0.1000mol·L-1 FeCl3溶液,发生Ti3++Fe3+=Ti4++Fe2+。当溶液出现红色达到滴定终点,用去了30.00mL FeC13溶液。待测钛液中TiOSO4的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
F、G都是常见的高分子材料,以下是由丙烯合成F、G的流程图。
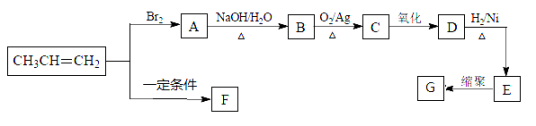
(1)E的化学名称是 ,所含官能团是 。
(2)G的结构简式是 。
(3)A→B的化学方程式是 ,该反应类型是 。
(4)由CH3CH=CH2生成F的化学方程式是 ,该反应类型是 。
(5)在一定条件下,两分子E脱去两分子水形成一种六元环状化合物,该化合物的结构简式是 。
(6)C的同分异构体有多种,请分别写出符合下列条件有机物的结构简式:
①能与NaHCO3溶液反应的是 ;
②能发生水解反应的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构如右图所示。常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法中错误的是( )

A.S2Cl2的电子式为![]()
B.S2Cl2为含有极性键和非极性键的非极性分子
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为:2S2Cl2 +2H2O===SO2↑+3S↓+4HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2Zn(OH)2ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2ZnCO3的工艺流程如下:
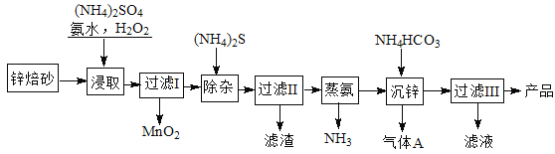
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液呈中性时, c(NH4+) 2c(SO42-)(填“<”、“>”或“=”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2能将Cu2+等离子转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×1024,Ksp(CuS)=1.3×1036+;K﹥105化学反应完全]
(5)“沉锌”的离子方程式为 。
(6)“过滤3”所得滤液可循环使用,其主要成分的化学式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作的说法正确的是( )。
A. 可用25mL碱式滴定管量取20.00mL KMnO4溶液
B. 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
C. 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全
D. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有下列离子中的几种(不考虑溶液中含有的较少的H+和OH-):Na+、NH4+、SO42-、CO32-、NO3-。取200 mL该溶液,分为两等份分别做下列实验。实验1:第一份加入足量的烧碱并加热,产生的气体在标准状况下为224 mL。实验2:第二份先加入足量的盐酸,无现象,再加足量的BaCl2溶液,得固体2.33g。下列说法正确的是
A.该溶液中可能含有Na+
B.该溶液中肯定含有NH4+、SO42-、CO32-、NO3-
C.该溶液中一定不含NO3-
D.该溶液中一定含Na+,且c(Na+) ≥ 0.1 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com