
下列说法中正确的是
A.常温下水电离出c(H+)×c(OH-)=10-20的溶液中:Na+、CIO-、SO42-、NH4+能大量共存
B.常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存
C.一定温度下,l L 0.5 mol·L-1NH4C1溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH4+物质的量相同
D.反应ZnS(s)+Cu2+(aq)=CuS(s)+Zn2+(aq)说明Ksp(ZnS)>Ksp(CuS)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届陕西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
下列离子能大量共存,且满足相应条件的是
选项 | 离子组 | 条件 |
A | K+,Na+,Cu2+,Cl- | 溶液呈无色 |
B | Na+,Fe3+,NO3-,SO42- | 滴入酸性KMnO4溶液,溶液褪色 |
C | Al3+,SO42-,Cl-,H+ | 加入氨水产生白色沉淀后沉淀溶解 |
D | Na+,NO3-,I-,SO42- | 加入盐酸和淀粉溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:填空题
实验室用固体烧碱配制0.1mol/L的NaOH溶液480mL,请回答:
(1)计算需要NaOH固体质量__________g;
(2)有以下仪器:①烧杯 ②药匙 ③250mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平 ⑦量筒.配制时,必须使用的玻璃仪器__________(填序号),还缺少的仪器是__________;
(3)使用容量瓶前必须进行的一步操作是__________;
(4)配制溶液时,在计算、称量、溶解、冷却后还有以下几个步骤,其正确的操作顺序为__________(填序号);①振荡摇匀;②洗涤;③定容;④颠倒摇匀;⑤转移.
(5)配制过程中,下列操作会引起结果偏高的是__________(填序号);
①未洗涤烧杯、玻璃棒;②称量NaOH的时间太长;③定容时俯视刻度;④容量瓶不干燥,含有少量蒸馏水;⑤NaOH溶液未冷却至室温就转移到容量瓶.
(6)现将200mL0.01mol/LNaOH与50mL0.02mol/LCa(OH)2溶液混合(混合后体积变化忽略不计),所得溶液中OH﹣的物质的量浓度是__________mol/L.
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三上学期期中测试化学试卷(解析版) 题型:选择题
下列关于电化学的叙述正确的是

A.图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B.图②装置可以验证牺牲阳极的阴极保护法
C.图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D.分别给上述4个装置的铁电极附近滴加少量K3[Fe(CN)6]溶液,②④出现蓝色沉淀
查看答案和解析>>
科目:高中化学 来源:2016届宁夏大学附属中学高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列溶液中,微粒浓度关系正确的是
A. 含有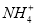 、Cl-、H+、OH-的溶液中,其离子浓度一定是:
、Cl-、H+、OH-的溶液中,其离子浓度一定是:
c(Cl-)>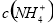 >
>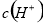 >
>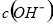
B. pH=6的醋酸与醋酸钠的混合溶液中,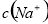 >
>
C. 0.1 mol/L 的Na2S溶液中,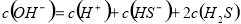
D. pH=3的一元酸和pH=11的一元碱等体积混和后的溶液中,一定是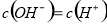
查看答案和解析>>
科目:高中化学 来源:2016届四川省绵阳市高三上学期第一次诊断性测试理综化学试卷(解析版) 题型:填空题
向恒容密闭容器中充入2.0 mol A和3.0 mol B,发生反应xA(g)+2B(g)  yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:
yC(g)。恒温下反应10 min后突然改变某一条件,12 min时达到化学平衡状态I;18 min时升高温度,22 min时达到化学平衡状态II。容器中A、C的物质的量浓度随时间变化的曲线如图所示,请根据题给信息回答下列问题:

(1)从反应开始到10 min时,该反应的平均速率v(A)= ;平衡状态I时,反应物A的转化率a(A)=__________。x:y=__________。
(2)容器内的压强:平衡状态I与起始状态相比较是__________(选填“增大”、“减小”、 “相等”或“无法判断”),逆反应为___________反应(选填“放热”或“吸热”)。
(3)推测第10 min时改变的反应条件可能是___________(选填编号)。
①减压 ②降温 ③升温 ④加催化剂 ⑤增加B的量 ⑥充入氦气
(4)若已知平衡状态I时B的物质的量为0.6 mol,平衡状态I和平衡状态Ⅱ时该反应的平衡常数分别为K1和K2。则Kl=_ ,且K1__________K2(选填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省龙海市高二上学期期中测试化学试卷(解析版) 题型:填空题
在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2 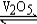 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上学期期中测试化学试卷(解析版) 题型:选择题
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2 +H2O CO2 +Pd↓ +2HC1。下列说法正确的是
A.题述反应条件下还原性:CO> Pd
B.题述反应中PdCl2被氧化
C.生成22.4 L CO2时,转移的电子为2 mo1
D.CO气体只有在高温下才能表现还原性
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江台州中学高二上第三次统练化学试卷(解析版) 题型:选择题
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O 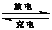 Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A.充电过程是化学能转化为电能的过程
B.充电时阳极反应为Cd(OH)2+2e- =Cd + 2OH -
C.放电时电池内部OH - 向正极移动
D.充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com