
【题目】用一种试剂即可将酒精、苯酚溶液、己烯、甲苯4种无色液体区分开来,这种试剂是( )
A.溴水 B.FeCl3溶液 C.KMnO4溶液 D.金属钠
科目:高中化学 来源: 题型:
【题目】Ⅰ.现有含CaO杂质的CaC2试样。设计以下实验,测定CaC2试样的纯度。(反应方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑),请从下图中选用适当的装置,完成该实验。
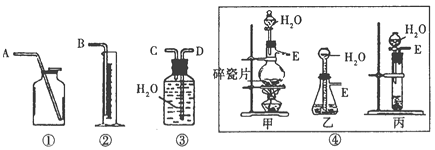
(1)制取C2H2最好选④中的_________装置(填“甲”“乙”或“丙”),所选用装置的连接顺序是_________________。(填各接口A~E的顺序)
(2)若实验时称取的试样为1.4 g,产生的乙炔在标准状况下的体积为448 mL,此试样中CaC2的质量分数为____________。(保留3位有效数字)
Ⅱ.某同学在实验室从如图标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成。从反应物及实验操作猜测:

该黑色物质可能为炭与另一种氧化物组成的混合物。根据题意和图示回答下面问题:
(1)装置图⑤中A的名称_______________。
(2)此氧化物可能是___________或___________(写化学式)。
(3)对黑色固体物质的组成作如图⑥所示探究

①实验I加入盐酸溶液的目的是________________。
②仅通过实验Ⅱ,用最简步骤能快速确定黑色氧化物的组成,请完善该设计。(限选试剂:稀盐酸、KSCN溶液、10%H2O2溶液)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MnO2与FeSO4溶液、硫酸充分反应后过滤,将滤液加热至60℃后,再加入Na2CO3溶液,最终可制得碱式碳酸锰[aMnCO3·bMn(OH)2·cH2O]。
(1)用废铁屑与硫酸反应制备FeSO4溶液时,所用铁屑需比理论值略高,原因是 ,反应前需将废铁屑用热Na2CO3溶液浸泡,其目的是 。
(2)为测定碱式碳酸锰组成,取7.390 g样品溶于硫酸,生成CO2 224.0 mL(标准状况),并配成500 mL溶液。准确量取10.00 mL该溶液,用0.0500 mol·L-1 EDTA(化学式Na2H2Y)标准溶液滴定其中的Mn2+(原理为Mn2+ +H2Y2-=MnY2-+2H+),至终点时消耗EDTA标准溶液28.00 mL。通过计算确定该样品的化学式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化工生产原理错误的是
①可以用电解熔融的氯化钠的方法来制取金属钠;
②可以用钠加入氯化镁饱和溶液中制取镁;
③用电解法冶炼铝时,原料是氯化铝;
④炼铁时高炉中所发生的反应都是放热的,故无需加热
A.②③ B.①③ C.①②③ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) ![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
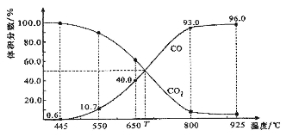
已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A.550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数。下列说法正确的是
A.标准状况下,7.8g苯中含有的碳碳双键数是0.3NA
B.标准状况下,11.2L四氯甲烷所含分子数为0.5NA
C.常温常压下,14g乙烯分子中含有的碳碳键数目为2NA
D.1mol甲基(-CH3)所含电子数为9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列判断或说法中正确的是
A.在相同的条件下红磷比白磷稳定
B.在相同的条件下,白磷比红磷稳定
C.红磷和白磷的物理性质相同
D.红磷容易发生自燃而白磷则不会自燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60,实验测知该物质属于离子化合物,具有良好的超导性。下列有关分析正确的是( )
A. K3C60中只有离子键 B. K3C60中不含共价键
C. 该晶体在熔融状态下能导电 D. C60与12C互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si 三种成分)进行分离、回收再利用的工业流程,通过该流程将各成分转化为常用的单质及化合物。

已知:298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ指的是 。
(2)加入过量FeCl3溶液过程中与较活泼的金属反应的离子方程式: 。
(3)过量的还原剂应是 ,溶液b中所含的金属阳离子有 。
(4)① 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为
② 若用X mol/LKMnO4溶液处理溶液b,当恰好反应时消耗KMnO4溶液Y mL,则最后所得红棕色固体C的质量为 g(用含X、Y的代数式表示)。
(5)常温下,若溶液c中所含的金属阳离子浓度相等,向溶液c中逐滴加入KOH溶液,则三种金属阳离子沉淀的先后顺序为: > > 。(填金属阳离子)
(6)最后一步电解若用惰性电极电解一段时间后,析出固体B的质量为m g,同时测得阴阳两极收集到的气体体积相等,则标况下阳极生成的最后一种气体体积为 L。(用含m的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com