



 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
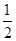 O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2
O2(g) ===CO(g);ΔH1 C(s)+O2(g) ===CO2(g);ΔH2| A.② | B.①② | C.①③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH1
CH3OH(g) ΔH1 CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
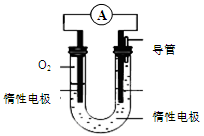
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
2SO3(g) △H<0反应,某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示,根据图示回答下列问题:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________ kJ能量。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 化学键 | 断开1mol化学键所需的能量(kJ) |
| H—H | 436 |
| O—H | 463 |
| O=O | 498 |
| 实验编号 | 反应物 | 催化剂 | |
| a | 50 mL 5% H2O2溶液 | | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| b | 50 mL 5% H2O2溶液 | 少量浓盐酸 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| c | 50 mL 5% H2O2溶液 | 少量浓NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
| d | 50 mL 5% H2O2溶液 | | MnO2 |
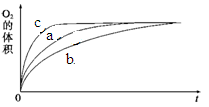
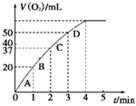
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.增大的CO浓度 | B.增大的H2O(g)浓度 | C.使用催化剂 | D.降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com