
【题目】如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X 为阳离子交换膜。下列有关说法正确的是
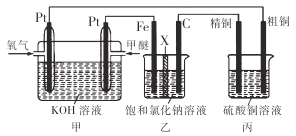
A. 乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
B. 反应一段时间后,乙装置中生成的氢氧化钠在铁极区
C. 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
D. 通入氧气的一极为正极,发生的电极反应为O2-4e-+2H2O=4OH-
【答案】B
【解析】因燃料在反应中失电子发生氧化反应,氧气在反应中得电子发生还原反应,故通入燃料的电极是负极,通入氧气的电极是正极,则甲为原电池,乙和丙为电解池。
A.乙装置中Fe电极连接甲装置中的负极,所以Fe为阴极,阴极受保护,故Fe不能发生反应,故A错误;
B.乙装置中的Fe电极为阴极,发生的电极反应为:2H2O+2e-=H2↑+2OH-,所以反应一段时间后,Fe电极附近生成NaOH,故B正确;
C.因粗铜中含有Zn、Fe等活泼性比铜强的金属,所以开始电解时,阳极发生的是Zn、Fe等失电子的反应,阴极发生的是铜离子得电子生成单质铜的反应,此时溶液中的硫酸铜浓度会减少,故C错误;
D.根据上述分析可知,通入氧气的电极是正极,氧气在反应中得电子,发生的反应是O2+4e-+2H2O=4OH-,故D错误;
故答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氨化法是合成硫酰氯(SO2Cl2)的常用方法,实验室合成的酰氯的反应和实验装置如下所示:SO2(g)+Cl2(g) ![]() SO2Cl2(1) ΔH=-97.3KJ/mol。
SO2Cl2(1) ΔH=-97.3KJ/mol。

已知: 一般条件下,硫酰氯为无色气体,熔点为-541℃,沸点为69.1℃,在潮湿空气中会“发烟”;100℃以上开始分解,生成二氧化硫和氧气,长期放置会分解。
请回答下列问题:
(1)装置甲中,70%的硫酸体现的性质为_________。
(2)仪器己中盛放的试剂主要用于排气,该试剂最合适的是______(填名称);实验时,从仪器己中放出该试剂的操作方法是_________。
(3)①装置庚中的药品最合适的是________(填字母);
a.五氧化二磷 b. 碱石灰 c.无水氯化钙 d.硅胶
②装置丙的冷凝管中出水口是_______(填标号)
(4)活性炭的作用是____;若缺少装置乙和丁(均盛放浓硫酸),潮湿的氯气和二氧化硫发生反应的化学方程式是________。
(5)为提高本实验的硫酰氯的产率,在实验操作中还需要注意的有______。
a.控制气流速度,宜慢不宜快
b.保证装置的气密性良好
c.先向装置丙中通入一种气体,排出空气后再通入另一种气体
d.先通气体,再通冷凝水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数为x的元素E在周期表中位于A,B,C,D四种元素中间(如图所示),则A,B,C,D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( ) 
A.4x
B.4x+6
C.4x+10
D.4x+14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,不能用H++OH-=H2O表示的是
A. 2NaOH+H2SO4 =Na2SO4+2H2O B. Ba(OH)2+2HCl=BaCl2+2H2O
C. Cu(OH)2+2HNO3=Cu(NO3)2+2H2O D. KOH+HCl=KCl+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH = 14的溶液中,下列离子能大量共存的是
A. Na+、Al3+ 、NO3-、Cl- B. Na+、SO4 2-、Cl- 、NH4+
C. K+、Cl-、Na+、HCO3- D. S2-、NO3-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】120 ℃条件下,一定质量的某有机物(只含C、H、O三种元素中的两种或三种)在足量O2中燃烧后,将所得气体先通过浓H2SO4,浓H2SO4增重2.7 g,再通过碱石灰,碱石灰增重4.4 g,对该有机物进行核磁共振分析,谱图如下图所示:

则该有机物可能是( )
A. CH3CH3 B. CH3CH2COOH
C. CH3CH2OH D. CH3CH(OH)CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置,持续通入X气体,可以看到a处有红色物质生成,b处变蓝,c处得到液体,则X气体是

A. H2 B. CH3CH2OH(气) C. CO2 D. CO和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,用CO2催化加氢可制取乙烯:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H<0
C2H4(g)+4H2O(g) △H<0
(1)若该反应体系的能量随反应过程变化关系如图所示,则该反应的△H=_______kJ/mol (用含a、b的式子表示)


(2)向1L容密闭容器中通入1 mol CO2和nmol H2,在一定条件下发生上述反应,测得CO2的转化率a(CO2)与反应温度、投料比X[![]() ]的关系如图所示。
]的关系如图所示。
①X1_______X2(填“>”“<”或“=”,下同),平衡常数Ka____Kb____Kc。
②若B点时X=3,则平衡常数Kb=__________(代入数据列出算式即可)。
③下列措施能同时满足增大反应速率和提髙CO2转化率的是______________。
a.升高温度 b.加入催化剂 c.增大投料比X d.增加压强
e.将产物从反应体系中分离出来
(3)乙烯也可作为制备甲酸的基础工业原料,常温时,HCOOH的电离平衡常数Ka=1.8×l0-4mol·L-1,pH=12的HCOONa和含少量NaOH混合溶液中。
①书写HCOONa的水解离子反应方程式_________________。
②该溶液中离子浓度关系:  =_________mol·L-1
=_________mol·L-1
③若0. lmol/L的HCOONa溶液中加入等体积的0.09mol/LHCOOH,配制了pH=6.8的溶液,则该溶液中微粒浓度由小到大的顺序为________________。(不考虑水分子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,不可通过调节反应物用量或浓度来改变反应产物的是
A. 二氧化碳通入石灰水 B. 硫化氢在氧气中燃烧
C. 锌片与硝酸溶液混合 D. 铁粉和硫加热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com