
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅤⅠA | ⅤⅡA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | E | ||||
| 3 | F | G | H | I | J | K | ||
| 4 | L | M |
 .
. 分析 根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,非金属性最强的位于周期表右上角,但稀有气体除外,最不活泼的元素是稀有气体元素;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵或硫酸氢铵,写一个即可;
(3)同一周期,随着原子序数的递增,非金属性增强,氢化物还原性减弱,据此解答即可;
(4)核外电子排布相同的微粒,原子序数越小,半径越大,据此解答即可;
(5)双氧水为共价化合物,据此解答即可.
解答 解:根据元素在周期表中的位置知,A、B、C、D、E、F、G、H、I、J、K、L、M分别是H、C、N、O、F、Na、Mg、Al、S、Cl、Ar、K、Ca元素,
(1)这些元素中,金属性最强的元素位于周期表左下角,为K元素,名称为钾,非金属性最强的位于周期表右上角,为F元素,名称为氟,最不活泼的元素是稀有气体元素,为Ar元素,原子半径最小的元素是H,故答案为:钾;氟;Ar;H;
(2)C的气态氢化物是氨气、I的最高价氧化物的水化物是硫酸,二者反应生成硫酸铵,反应方程式为2NH3+H2SO4=(NH4)2SO4,
故答案为:2NH3+H2SO4=(NH4)2SO4;
(3)同周期自左而右非金属性增强,非金属性越强,氢化物还原性越弱,故氢化物还原性:HF<H2O<NH3,故答案为:HF<H2O<NH3;
(4)S2-、Cl-、K+、Ca2+是核外电子排布相同的离子,原子序数越小,半径越大,故微粒中S2-的半径最大,Ca2+的半径最小,故答案为:S2-;
(5)双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故答案为:共价;
,故答案为:共价; .
.
点评 本题主要考查元素周期表和元素周期律综合应用,明确元素非金属性、金属性强弱判断方法即可解答,熟练掌握元素周期律并灵活运用,题目难度不大.


科目:高中化学 来源: 题型:填空题
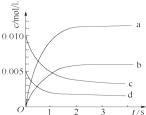 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式相同的不同物质一定是同分异构体 | |
| B. | 通式相同的不同物质一定属于同系物 | |
| C. | 相对分子质量相同的不同物质一定是同分异构体 | |
| D. | 分子式相同,元素的质量分数也相同的物质是同种物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
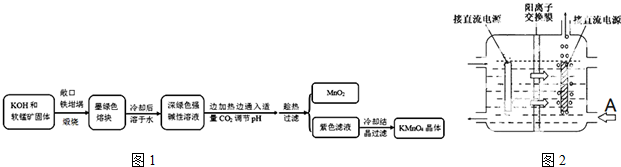
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH可能等于7 | |
| B. | c(HCO3- )=c(CH3COO-) | |
| C. | c(OH-)=$\frac{c(C{H}_{3}COOH)Kw}{c(C{H}_{3}CO{O}^{-})Ka}$ | |
| D. | c(HCO3- )+c(H2CO3)+c(CO3 2-)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com