
MnO2��һ����Ҫ�������ܲ��ϣ���MnO2���ᴿ�ǹ�ҵ��������Ҫ���ڡ�ij�о���ѧϰС������˽���MnO2(���н϶��MnO��MnCO3)��Ʒת��Ϊ��MnO2��ʵ�飬���������£�
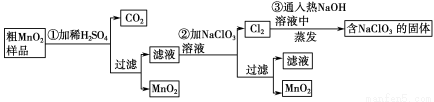
(1)�ڢٲ���ϡH2SO4ʱ����MnO2��Ʒ�е� (д��ѧʽ)ת��Ϊ���������ʡ�
(2)�ڢڲ���Ӧ�����ӷ���ʽ�� ��
�� ClO3����
ClO3���� =
= MnO2����
MnO2���� Cl2����
Cl2���� ��
��
(3)�ڢ۲������������������������̨(����Ȧ)�� �� �� ����֪�����õ��Ĺ�������NaClO3��NaOH����һ�������� (д��ѧʽ)��
(4)����MnO2��Ʒ������Ϊ12.69 g���ڢٲ���Ӧ�����˵õ�8.7 g MnO2�����ռ���0.224 L CO2(��״����)�����ڵڢڲ���Ӧ��������Ҫ mol NaClO3��
(1)MnO��MnCO3
(2)5��Mn2����2��4��H2O��5��1��8��H��
(3)�ƾ��ơ�������������NaCl
(4)0.02
��������������MnO2���ᴿΪ����������������ԭ��Ӧ����ʽ����ƽ�����ʵķ������ᴿ�����ʵ������йؼ����֪ʶ��(1)������������ͼ֪��Ʒ�е�MnO��MnCO3����ϡ���ᷴӦת��ΪMnSO4��������Һ��(2)�û��ϼ�����������д������ƽ�ڢڲ���Ӧ�����ӷ���ʽ��5Mn2����2ClO3����4H2O=5MnO2����Cl2����8H����(3)Cl2ͨ����NaOH��Һ�У����ɵ�NaClO3��Ȼ�����������ô0�۵���Ԫ�ػ��ϼ۽������ɵĻ�ԭ�����Ȼ��NaCl��(4)n(MnCO3)��n(CO2)��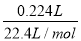 ��0.01 mol��n(MnO)��
��0.01 mol��n(MnO)��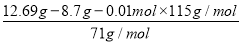 ��0.04 mol����MnO��MnCO3����ϡ�������ɵ�Mn2�������ʵ���n(Mn2��)��n(MnO)��n(MnCO3)��0.05 mol���ɵڢڲ���Ӧ��ѧ����ʽ֪����Mn2��������NaClO3��
��0.04 mol����MnO��MnCO3����ϡ�������ɵ�Mn2�������ʵ���n(Mn2��)��n(MnO)��n(MnCO3)��0.05 mol���ɵڢڲ���Ӧ��ѧ����ʽ֪����Mn2��������NaClO3��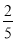 ��0.05 mol��0.02 mol��
��0.05 mol��0.02 mol��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ���ͳ����ϰ �л������ɡ��ṹ�����ʣ������棩 ���ͣ�ѡ����
�л������������ǵ�����ϢϢ��أ�����˵����ȷ���ǣ� ��
A���ױ�����������֬���������ɿ���ȡ����Ӧ
B��������ˮ�����������Ƿų��������ṩ�����������
C��ʯ���ѽ��Ŀ����Ϊ���������Һ��ȼ�ϵIJ���������
D�����ͺϳ���ά����Ҫ�ɷ�����ά��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ���ͳ����ϰ ��ѧ������������ѧ��STSE���⣨�����棩 ���ͣ�ѡ����
��ɽ�緢ʱ�������Ļ�ɽ������Ҫ����ˮ������CO2��CO��SO2��SO3��H2S��HCl��Cl2��HF�����ʡ���Щ������Զ�������ɼ������ص�Σ�������ж���Щ������˺Ͷ�����ɵ�Σ����������ȷ���ǣ� ��
A����CO2����ɵ�����ۼ��ڻ�ɽ�ڸ����ĵ��ݵ����������γɡ���������ʹ������
�еĶ�����Ϣ����
B��SO2��SO3��H2S�Ⱥ�����������γ������⣬����ֲ���뽨������Ӱ�죬�䱾
���Ķ��Բ���
C������CO�Ĵ��ڣ���ʹ�˻���ѪҺ�е�Ѫ�쵰�������������ͣ��Ӷ����ȱ��
D����ɽ�����еķ������ʹ��������ݱ���ɴಢ�����䣬�Զ������Σ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�ר��3���������ӹ��漰���ӷ���ʽ��д��ϰ���������棩 ���ͣ�ѡ����
��pH��1����Һ�У��ܴ��������һ�����ӻ�����ǣ� ����
A��Mg2����Na����ClO����NO3��
B��Al3����NH4����Br����Cl��
C��K����Cr2O72����CH3CHO��SO42��
D��Na����K����SiO32����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�ר��3���������ӹ��漰���ӷ���ʽ��д��ϰ���������棩 ���ͣ�ѡ����
���и���������ָ���Ļ�����һ���ܴ���������ǣ� ����
A���μ�ʯ����Һ�Ժ�ɫ����Һ��Fe3����NH4����Cl����SCN��
B�����д���HCO3������Һ��NH4����Ca2����Mg2����I��
C�����������ܲ���H2����Һ��NH4����Fe2����SO42����NO3��
D�����д���ClO������Һ��H����Mg2����I����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��2 �����ӵ��������ж���ϰ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ���ǣ� ����
A����״���£���22.4 L�Ȼ�����������ˮ�У���Һ�к��е�HCl������ΪNA
B�����³�ѹ�£�16 g 14CH4����������ĿΪ8NA
C�����³�ѹ�£�7.1 g Cl2������NaOH��Һ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.1 NA
D����״���£�22.4 L��������NA�����ʷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��2 �����ӵ��������ж���ϰ���������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ������������ȷ���ǣ� ����
A����״���£�2.24 L Cl2ͨ������NaOH��Һ�У���Ӧת�Ƶ��ӵ���ĿΪ0.2NA
B�������£�0.1 mol��L��1 NH4NO3��Һ��NO3����ĿΪ0.1NA
C�����³�ѹ�£�4.0 g CH4�к��й��ۼ�����ĿΪNA
D����״���£�22.4 L CHCl3���з��ӵ���ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��߿���ѧ�ս̰�һ�ָ�ϰר��1 ��ѧʵ�������Ĵ���ʹ����ϰ���������棩 ���ͣ�ѡ����
����ͼ��ʾװ�ý�������ʵ�飬�ܴﵽʵ��Ŀ�ĵ��� (����)��
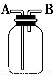
A��ƿ��ʢ������ŨH2SO4����A�ڽ���������NH3
B����B�ڽ��������ſ������ռ�CO2
C��ƿ��ʢ��ˮ����B�ڽ���������ˮ���ռ�NO2
D��ƿ��װ��ˮ��A�����ӵ��ܲ�������Ͳ�У���B�ڽ���������ˮ����������H2�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014����л�ѧ³�ư�ѡ���ĵ�1�� ��ѧ��Ӧ������ת����ϰ���������棩 ���ͣ�ѡ����
��֪2Zn(s)��O2(g)=2ZnO(s)��H����701.0 kJ��mol��1
2Hg(l)��O2(g) 2HgO(s)��H����181.6 kJ��mol��1
2HgO(s)��H����181.6 kJ��mol��1
��ӦZn(s)��HgO(s)=ZnO(s)��Hg(l)�Ħ�HΪ(����)
A����519.4 kJ��mol��1��������B����259.7 kJ��mol��1
C����259.7 kJ��mol��1 D����519.4 kJ��mol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com