
碱式碳酸铜和氯气都是用途广泛的化工原料。
(1)工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜,其制备过程如下:

已知:Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
开始沉淀pH | 4.2 | 5.8 | 1.2 |
完全沉淀pH | 6.7 | 8.3 | 3.2 |
①氯酸钠的作用是???????????? ;
②反应A后调节溶液的pH范围应为?????????????????????????? 。
③第一次过滤得到的产品洗涤时,如何判断已经洗净????????????????????? 。
④造成蓝绿色产品中混有CuO杂质的原因是???????????????????? 。
(2)某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
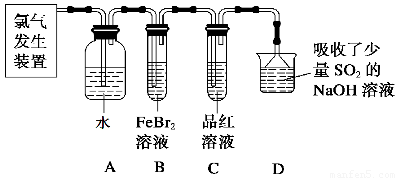
①实验室用二氧化锰和浓盐酸加热制取氯气,所用仪器需要检漏的有??? ????????? ????? 。
②若C中品红溶液褪色,能否证明氯气与水反应的产物有漂白性,说明原因 ????????? ?? 。此时B装置中发生反应的离子方程式是___________?????????????? _____。
③写出A溶液中具有强氧化性微粒的化学式????????? ??????????????????? ?? 。若向A溶液中加入NaHCO3粉末,会观察到的现象是????????????????????? 。
(1)①将Fe2+氧化成Fe3+并最终除去②3.2-4.2③取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净④? 反应B的温度过高
(2)①分液漏斗? ②不能证明? 因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白
2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
③ Cl2?? HClO?? ClO-???? 有无色气体产生???? (1分 )
【解析】
试题分析:(1)该化学工艺流程的目的用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl?)制备碱式碳酸铜。必须除去废液Fe2+、Fe3+,结合题给数据分析,需先将Fe2+氧化为Fe3+才能与Cu2+分离开。由题给流程图分析,刻蚀废液加入氯酸钠经反应A将Fe2+氧化为Fe3+,结合题给数据知加入试剂调节pH至3.2-4.2,Fe3+转化为氢氧化铁沉淀经过滤除去,滤液中加入碳酸钠经反应B生成碱式碳酸铜,过滤得产品。①由上述分析知,氯酸钠的作用是将Fe2+氧化成Fe3+并最终除去;②反应A后调节溶液的pH的目的是将铁离子转化为氢氧化铁沉淀而除去,pH范围应为3.2-4.2;③第一次过滤得到的产品为氢氧化铁,表面含有氯离子等杂质离子。洗涤时,判断已经洗净的方法是取最后一次洗涤液,加入硝酸银、稀硝酸,无沉淀生成则表明已洗涤干净;④碱式碳酸铜受热分解生成氧化铜,造成蓝绿色产品中混有CuO杂质的原因是反应B的温度过高。(2)①? 实验室用二氧化锰和浓盐酸加热制取氯气为固液加热制气体的装置,所用仪器需要检漏的有分液漏斗;②? 若C中品红溶液褪色,不能证明氯气与水反应的产物有漂白性,原因是 因为Cl2也有氧化性,此实验无法确定是Cl2还是HClO漂白;C中品红溶液褪色,说明装置B中氯气已过量,此时B装置中亚铁离子和溴离子均已被氧化,发生反应的离子方程式是2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 ;③? 氯气与水反应生成盐酸和次氯酸,该反应为可逆反应,次氯酸为弱酸,则A溶液中具有强氧化性微粒的化学式Cl2?? HClO?? ClO- ;若向A溶液中加入NaHCO3粉末,盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,会观察到的现象是有无色气体产生。
考点:以化学工艺流程为载体考查物质的分离提纯等实验基本操作,考查氯气的制备和性质。


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com