
【题目】四种水溶液①HCl,②FeCl3,③KOH,④Na2SO3其 PH值依次为4、4、10、10,而溶液中水的电离程度依次为α1、α2、α3、α4,则它们的关系正确的是( )
A. α1=α2=α3=α4 B. α1>α3>α2>α4
C. α4=α2>α3=α1 D. α1=α3>α2=α4
科目:高中化学 来源: 题型:
【题目】高分子树脂 ,化合物C和化合物N的合成路线如下
,化合物C和化合物N的合成路线如下
 已知:
已知: (1)A的结构简式为__________________,D的含氧官能团的名称是_______________。
(1)A的结构简式为__________________,D的含氧官能团的名称是_______________。
(2)A在催化剂作用下可与足量H2反应生成B.该反应的反应类型是____________,酯类化合物C的结构简式是________________________________________。
(3)F与醛类化合物M合成高分子树脂的化学方程式是____________________________________。
(4)酯类化合物N在NaOH溶液中发生水解反应的化学方程式是____________________________。
(5)扁桃酸( )有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有______种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式________________________________________________。
)有多种同分异构体.其中含有三个取代基,能与FeCl3溶液发生显色反应,也能与NaHCO3溶液反应放出气体的同分异构体共有______种,写出符合条件的三个取代基不相邻的一种同分异构体的结构简式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 用精密pH试纸测得饱和氯水的pH约为2.2
B. 配制一定物质的量浓度的溶液,定容时仰视刻度,溶液浓度偏小
C. 在中和滴定实验中,锥形瓶需用待测液润洗
D. 制备乙酸乙酯时,将乙醇和乙酸依次加入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s) △H3
2FeO(s) △H3
(1) △H3=___________(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=____________,已知500℃时反应①的平衡常数K=1,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为______________ ,CO的平衡浓度为________________。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a ___________0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关纯净物、混合物、电解质、非电解质的正确组合为
选项 | 纯净物 | 混合物 | 电解质 | 非电解质 |
A | 盐酸[来 | 淀粉溶液 | 硫酸 | 液氨 |
B | 漂粉精 | 水玻璃 | 氧化铝 | 二氧化硫 |
C | 胆矾 | 氢氧化铁胶体 | 碳酸钠[来 | 乙醇 |
D | 水银 | 澄清石灰水 | 氯化铜 | 铁 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六种物质:①Na2O ②Na2O2 ③NaCl ④Na2CO3溶液 ⑤NaOH ⑥NaHCO3,其中不能与CO2反应的是
A. ①④B. ②③C. ③⑥D. ⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肌肉蛋白和血红蛋白都是蛋白质,但它们的功能不同,其直接原因最可能是
A. 它们的组成元素不同
B. 它们的相对分子质量不同
C. 它们的分布部位不同
D. 它们所含的氨基酸种类、数目、排列顺序及空间结构不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下下列说法正确的是( )
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 改变压强,平衡不发生移动,反应放出的热量变大
C. 升高温度,反应速率加快,反应放出的热量不变
D. 增加反应物的浓度,反应速率加快,原因是单位体积内增加了活化分子的数目。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在2 L的密闭容器中,A气体与B气体发生可逆反应生成C气体,
反应过程中A、B、C物质的量变化如下图(Ⅰ)所示。若保持其它条件不变,
温度分别为T1和T2时,B的物质的量分数与时间关系如下图(Ⅱ)所示。下列
叙述正确的是
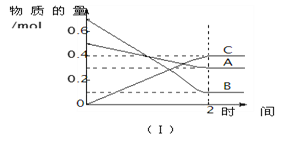
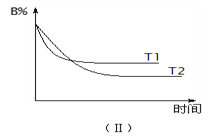
A. 2 min内A的化学反应速率为0.1 mol/(L·min)
B. 在反应达平衡时,保持其他条件不变,增大压强,正逆反应速率都增大,且平衡向逆反应方向移动
C. 在反应达平衡时,其它条件不变,升高温度,正逆反应速率都增大,且A的转化率增大
D. 在T℃时,若A的浓度减少了0.1 mol/L,则B的浓度会减少0.3 mol/L,C的浓度会增加0.2 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com