
六氟化硫(SF6)具有良好的高压绝缘性,在电器工业中有着广泛的用途,SF6分子呈正八面体结构,S 原子位于正八面体的中心。下列关于SF6的推测中,正确的是
A.SF6在氧气中燃烧可生成SO2
B.SF6晶体是原子晶体
C.SF6是非极性分子
D.SF6中各原子的最外电子层都达到8电子稳定结构
科目:高中化学 来源: 题型:
下列溶液与100mL0.5mol/LNa2SO4溶液中的 Na+的物质的量浓度相等的是( )
|
| A. | 200mL0.5mol/LNaCl溶液 | B. | 100mL1mol/LNa2CO3溶液 |
|
| C. | 100mL0.5mol/LNa3PO4溶液 | D. | 1L1mol/LNaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是 溶液,D是 溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是 .
A.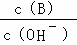 B.
B.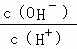 C.c (H+)•c (OH﹣) D.n (OH﹣)
C.c (H+)•c (OH﹣) D.n (OH﹣)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则 (填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 .
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10﹣7mol/L,则 Ksp[Mg(OH)2]= .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的离子方程式的书写中,正确的是
A.C12通入水中:C12+H2O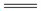 2H++Cl-+ClO-
2H++Cl-+ClO-
B.硫酸铝溶液与过量氨水反应:Al3++3NH3·H2O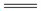 3
3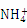 +Al(OH)3↓
+Al(OH)3↓
C.实验室用石灰石和盐酸反应制取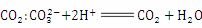
D.向Na2SO3溶液中加入稀硝酸:
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是 。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g) ZnO(s) ΔH=-332 kJ/mol
ZnO(s) ΔH=-332 kJ/mol
ZnO(s) + H2SO4(aq)  ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
ZnSO4(aq) + H2O(l) ΔH =-112kJ/mol
H2(g) +1/2 O2(g) H2O(l) ΔH =-286kJ/mol
H2O(l) ΔH =-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2 时的反应热ΔH = kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。

实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) | 34 | 59 | 86 | 117 | … | 102 |
| 1分钟水滴数(闭合K) | 58 | 81 | 112 | 139 | … | 78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_________。
③ 从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关溶液(均在常温下)的结论正确的是( )
|
| A. | pH=1的盐酸与pH=5的盐酸等体积混合后pH=3 |
|
| B. | 0.1mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和 |
|
| C. | pH>7的溶液中不可能存在CH3COOH分子 |
|
| D. | 等浓度等体积的KOH溶液和CH3COOH溶液混合后:c(CH3COO﹣)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
反应4NH3(g)+5O2(g)⇌4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后,水蒸气的物质的量增加了4.5mol,则此反应的平均速率 (反应物的消耗速率或产物的生成速率)可表示为( )
(反应物的消耗速率或产物的生成速率)可表示为( )
|
| A. | v(NH3)=0.01mol/(L•s) | B. | v(O2)=0.03mol/(L•s) |
|
| C. | v(NO)=0.02mol/(L•s) | D. | v(H2O)=0.04mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语正确的是( )
|
| A. | 1,2﹣二溴乙烷的结构简式:C2H4Br2 |
|
| B. | 羟基的化学式:OH﹣ |
|
| C. | 己烷的分子式:C6H12 |
|
| D. | 乙烯分子的最简式:CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com