
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )
A.简单离子半径:W<X<Z
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:W<Y
D.最高价氧化物的水化物的酸性:Y>Z
【答案】B
【解析】解:四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X是钠;Z与X形成的离子化合物的水溶液呈中性,说明这种盐不水解,Z只能是第三周期的非金属元素,且Z的氢化物的水溶液属于强酸,则Z是氯;W、X的简单离子具有相同电子层结构,则W在第二周期且是非金属元素,可能是氮和氧;W与Y同族,
Y在X与Z之间,位置关系如图: 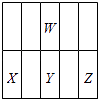 ,
,
A.X、W离子的电子层为2层,Z离子即氯离子电子层为3层,电子层多半径大,电子层结构相同时,序小半径反而大,
则简单离子半径大小顺序是:X<W<Z,故A错误;
B.W在第二周期且是非金属元素,可能是氮和氧,与钠形成的化合物可能是氮化钠,氧化钠,过氧化钠,它们与水反应都能生成氢氧化钠使溶液呈碱性,故B正确;
C.W与Y处于同于主族,从上到下,非金属性逐渐减弱,气态氢化物的热稳定性逐渐减弱,则W>Y,故C错误;
D.Y与Z处于同同期,从左到右,非金属性逐渐增强,最高价氧化物的水化物的酸性逐渐增强,则Z>Y,故D错误;
故选:B.
四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X是钠;Z与X形成的离子化合物的水溶液呈中性,说明这种盐不水解,Z只能是第三周期的非金属元素,且Z的氢化物的水溶液属于强酸,则Z是氯;W、X的简单离子具有相同电子层结构,则W在第二周期且是非金属元素,可能是氮和氧;W与Y同族,
Y在X与Z之间,位置关系如图: 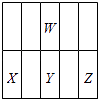 ,据此解答.
,据此解答.


科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为5mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求: ①合金中Mg的质量?
②所用HCl的物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物X的结构简式为  ,下列有关叙述不正确的是( )
,下列有关叙述不正确的是( )
A.1molX分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的量分别为3 mol、4 mol、1mol
B.X在一定条件下能与FeCl3溶液发生显色反应
C.X在一定条件下能发生消去反应和酯化反应
D.X的化学式为C10H10O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,C元素的单质可以在D和F组成的一种气态化合物中燃烧。E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
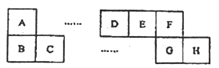
(1)G对应的元素名称是_________________。
(2)上述元素所形成的气态单质中能用于饮用水消毒的是________或________(写化学式)。
(3)B、E、F的简单离子半径由大到小的顺序为____________(用离子符号表示)。
(4)与C相似,B元素的单质也可以在D和F组成的气态化合物中燃烧,产物为一种正盐和一种黑色固体,该反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= , 该反应为反应(填吸热或放热). 若改变条件使平衡向正反应方向移动,则平衡常数(填序号)
①一定不变 ②一定减小 ③可能增大 ④增大、减小、不变皆有可能
(2)能判断该反应是否达到化学平衡状态的依据是 . (a)容器中压强不变 (b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O) (d)c(CO)=c(CO2)
(3)将不同量的CO (g) 和H2O (g) 分别通入到体积为2L的恒容密闭容器中,进行反应CO (g)+H2O (g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
A | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
B | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
C | 900 | a | b | c | d | t |
①实验A中以υ(H2) 表示的反应速率为
②通过计算可知,CO的转化率实验A实验B(填“大于”、“等于”或“小于”),该反应的正反应为(填“吸”或“放”)热反应.
③若实验C要达到与实验B相同的平衡状态,则a、b应满足的关系是(用含a、b的数学式表示).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com