
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源:连州中学2008届高三化学第二轮复习实验题训练 题型:058
(Ⅰ)某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

请根据上面流程,回答以下问题:
(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________,(填仪器名称)
操作Ⅱ必须用到的仪器是________.(填编号)
A.50 mL烧杯 B.50 mL量筒 C.100 mL量筒 D.25 mL滴定管
(2)请写出加入溴水发生的离子反应方程式___________________,
加入氨水要过量的原因是__________________________.
(3)检验沉淀是否已经洗涤干净的操作是_____________________________
(4)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2=0.3 g,则接下来还应进行的操作是________________________.
(5)若蒸发皿质量是W1 g,蒸发皿与加热后固体总质量是W2 g,则样品中铁元素的质量分数是________(列出原始算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是________________________________.(写出一种原因即可).
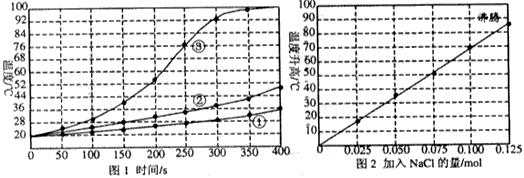
(Ⅱ)士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量.下面是在形同的室温下对该产品的两个探究实验:
实验1:向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1.
①1.0 mol镁条、0.10 mol铁粉、0.10 mil氯化钠粉末;
②将1.0 mol镁条剪成100份、0.10 mol铁粉、0.10 mil氯化钠粉末;
③1.0 mol镁粉、0.10 mol铁粉、0.10 mil氯化钠粉末;

实验2:向加有100 mL水的隔热容器中分别加入0.10 mol镁粉、0.50 mol铁粉及不同量的氯化钠粉末,不断搅拌,第15 min时记录温度升高的幅度参见上图2.
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是________.
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是__________.
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060 mol NaCl,则第15 min时混合物的温度最接近于________.
A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是______________________________________.
查看答案和解析>>
科目:高中化学 来源:浙江省模拟题 题型:填空题

查看答案和解析>>
科目:高中化学 来源:0115 月考题 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:
士兵在野外加热食物时通常采用“无焰食物加热器”,其主要化学成分为镁粉、铁粉、氯化钠,使用时加入水与其中的镁反应放出热量。下面是在形同的室温下对该产品的两个探究实验:
【实验1】向加有等量水的隔热容器中分别加入下列各组物质,结果参见下图1。
①1.0mol镁条、0.10mol铁粉、0.10mil氯化钠粉末;
②将1.0mol镁条剪成100份、0.10mol铁粉、0.10mil氯化钠粉末;
③1.0mol镁粉、0.10mol铁粉、0.10mil氯化钠粉末;
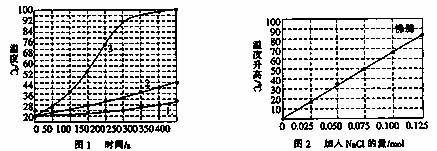
【实验2】向加有100mL水的隔热容器中分别加入0.10mol镁粉、0.50mol铁粉及不同量的氯化钠粉末,不断搅拌,第15min时记录温度升高的幅度参见上图2。
请回答下列问题:
(1)实验1证实影响镁与水反应速率的主要因素是 。
A.反应温度 B.NaCl的用量 C.铁的用量 D.镁的表面积
(2)实验2中当NaCl的用量大于0.125mol时,实验就无须再做的原因是 。
A.加入更多的NaCl不再增加反应速率 B.加入NaCl反而会降低反应速率
C.已达到沸点不再有温度变化 D.需要加入更多的铁粉来提高温度
(3)如果在实验2中加入了0.060molNaCl,则第15min时混合物的温度最接近于 。A.34℃ B.42℃ C.50℃ D.62℃
(4)铁粉、NaCl能使反应速率增加的原因是
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
将煤气化转化成合成气,然后通过一碳化工路线合成各种油品和石化产品是一碳化工的极为重要的领域,具有广阔的前景,在未来相当一段时期将成为一碳化工的主要领域。除去水蒸气后的水煤气含55~59%的H2,15~18%的CO,11~13%的CO2,少量的H2S、CH4,除去H2S后,可采用催化或非催化转化技术,将CH4转化成CO,得到CO、CO2和H2的混合气体,是理想的合成甲醇原料气,即可进行甲醇合成。
水煤气法制甲醇工艺流程框图如下
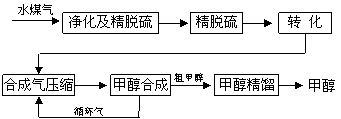 |
(1)制水煤气的主要化学反应方程式为:C(s)+H2O(g)![]() CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。① 此反应的化学平衡常数表达式为 ;
②下列能增大碳的转化率的措施是 ;(填字母代号)
A.加入C(s) B.加入H2O(g) C.升高温度 D.增大压强
(2)合成气经压缩升温后进入10m3甲醇合成塔,在催化剂作用下,进行甲醇合成,
主要反应如下: 2H2(g) + CO(g) ![]() CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
CH3OH(g);ΔH =-90.8kJ·mol-1,T4℃下此反应
的平衡常数为160。此温度下,在密闭容器中加入CO、H2,反应到某时刻测得各组
分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol·L-1) | 0.2 | 0.1 | 0.4 |
① 比较此时正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”)。
② 若加入CO、H2后,在T5℃反应10min达到平衡,c(H2)=0.4 mol·L-1,则该时间内反应速率v(CH3OH) = mol-1·(Lmin)-1。
(3)生产过程中,合成气要进行循环,其目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com