
| A. | 溶质的质量分数为ω=$\frac{a}{{V}_{ρ}-a}$×100% | |
| B. | 溶质的物质的量浓度c=$\frac{1000a}{17V}$mol•L-1 | |
| C. | 溶液中c(OH-)=$\frac{1000b}{V}$mol•L-1+c(H+) | |
| D. | 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω |
分析 A、氨水溶液溶质为氨气,该溶液的密度为ρ g•cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,根据溶质的质量分数定义计算;
B、根据n=$\frac{m}{M}$计算a g NH3的物质的量,溶液体积为VmL,再根据c=$\frac{n}{V}$计算溶液的物质的量浓度;
C、溶液OH-中来源与一水合氨、水的电离,NH4+的浓度为$\frac{bmol}{V×1{0}^{-3}L}$=$\frac{1000b}{V}$mol/L,一水合氨电离NH3•H2O?NH4++OH-,一水合氨电离出的OH-浓度为$\frac{1000b}{V}$ mol/L;
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,据此判断.
解答 解:A、氨水溶液溶质为氨气,该溶液的密度为ρ g•cm-3,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为$\frac{ag}{ρVg}$×100%,故A错误;
B、a g NH3的物质的量为$\frac{ag}{17g/mol}$=$\frac{a}{17}$mol,溶液体积为VmL,所以溶液的物质的量浓度为$\frac{\frac{a}{17}mol}{V×1{0}^{-3}L}$=$\frac{1000a}{17V}$mol/L,故B正确.
C、溶液OH-来源于一水合氨、水的电离,NH4+的浓度为$\frac{bmol}{V×1{0}^{-3}L}$=$\frac{1000b}{V}$mol/L,一水合氨电离NH3•H2O?NH4++OH-,一水合氨电离出的OH-浓度为$\frac{1000b}{V}$ mol/L,所以溶液中OH-浓度大于$\frac{1000b}{V}$ mol/L,故C错误;
D、水的密度比氨水的密度大,相等体积的氨水与水,水的质量大,等体积混合后溶液的质量大于原氨水的2倍,溶液中氨气的质量相同,等体积混合所得溶液溶质的质量分数小于0.5ω,故D错误;
故选B.
点评 考查物质的量浓度、质量分数的计算与相互关系等,难度中等,理解概念是解题的关键.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合理开发利用可燃冰可缓解能源紧缺 | |
| B. | 用食醋可除去热水壶内壁的水垢 | |
| C. | 明矾可用于自来水的消毒、杀菌 | |
| D. | 船舶外壳装上锌块可以减缓其腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | H-H | C-H | C≡C |
| 键能/kJ•mol-1 | a | b | c |
| A. | (b-c-a)kJ•mol-1 | B. | (c+3a-4b)kJ•mol-1 | C. | (6b-c-3a)kJ•mol-1 | D. | (c+3a-6b)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、Cl-、NO3- | D. | Fe3+、Ag+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
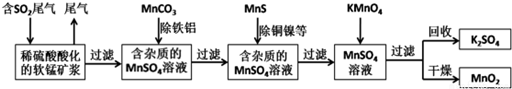
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al→Al2O3→Al(OH)3→AlCl3 | B. | Fe→FeCl3→Fe(OH)3→Fe2O3 | ||
| C. | Mg→MgCl2→Mg(OH)2→MgSO4 | D. | Na→NaOH→Na2CO3→NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com