
| A. | 实现化石燃料清洁利用,就无需开发新能源 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| D. | 为提高农作物的产量和质量,应大量使用化肥和农药 |
分析 A.根据化石燃料属于不可再生资源,进行分析判断;
B.根据垃圾中含有大量可回收利用的资源,进行分析判断;
C.依据绿色化学核心解答;
D.大量使用农药和化肥,会造成土壤、水体的污染等,据此进行分析判断.
解答 解:A.即使实现了化石燃料清洁利用,由于化石燃料属于不可再生资源,也需要开发新能源,故A错误;
B.垃圾中含有大量可回收利用的资源,垃圾是放错地方的资源,应分类回收利用,故B正确;
C.绿色化学的核心是利用化学原理从源头消除污染,故C错误;
D.大量使用农药和化肥,会造成土壤、水体的污染等,不利于保护土壤、水资源等,应合理使用,故D错误;
故选:B.
点评 本题考查了化学与生产生活,了解垃圾回收利用的优点、绿色化学的概念、化肥与农药对环境的影响等是正确解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 元素X、Y的简单离子具有相同的电子层结构 | |
| B. | 由Z、W两种元素组成的化合物是离子化合物 | |
| C. | W的简单气态氢化物的热稳定性比X的强 | |
| D. | 离子半径:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 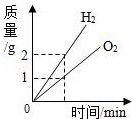 电解水生成氢气和氧气的质量与反应时间的关系 | |
| B. | 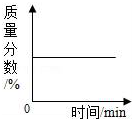 加热一定量高锰酸钾固体制氧气,剩余固体中锰元素的质量分数与反应时间的关系 | |
| C. | 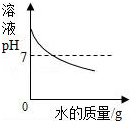 向氢氧化钠溶液中不断加水,溶液PH与加入水的质量关系 | |
| D. | 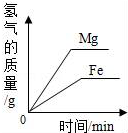 相同质量的Mg、Fe分别与足量的稀盐酸反应,产生氢气的质量与反应时间的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:4 | C. | 4:1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 6种 | C. | 9 种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,溶液中离子浓度都减小 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol•L-1CH3COOH溶液,溶液中c(H+)减小 | |
| D. | 加入少量CH3COONa固体,电离平衡常数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
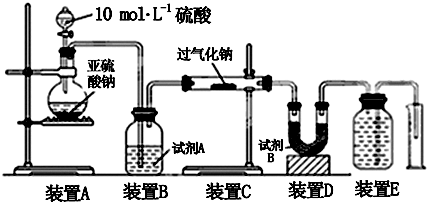
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com