
��7�֣���ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��. SO2��2H2O��I2===H2SO4��2HI
��. 2HI H2��I2
H2��I2
��. 2H2SO4===2SO2��O2��2H2O
(1) ����������Ӧ�������ж���ȷ���� _______________
a����Ӧ�����ڳ����½���
b����Ӧ����SO2�����Ա�HIǿ
c��ѭ���������貹��H2O
d��ѭ�����̲���1 mol O2��ͬʱ����1 mol H2
(2) һ���¶��£���1 L�ܱ������м���1 mol HI(g)��������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
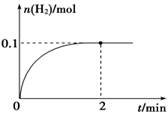
�� 0��2 min�ڵ�ƽ����Ӧ����v(HI)�� ________________
�� ���¶��£�H2(g)��I2(g)  2HI(g)��ƽ�ⳣ��K�� __________________
2HI(g)��ƽ�ⳣ��K�� __________________
�� ��ͬ�¶��£�����ʼ����HI(g)�����ʵ�����ԭ����2������ _____________��ԭ����2����
a��ƽ�ⳣ�� b��HI��ƽ��Ũ��
c���ﵽƽ���ʱ�� d��ƽ��ʱH2���������
(3) ʵ������Zn��ϡ������ȡH2����Ӧʱ���������������Լ��е�____________����H2�����ʽ�����
a��NaNO3 b��CuSO4 c��Na2SO4 d��NaHSO3
��1��C(1��)��2����0.1mol/(L.min)��2�֣� ��64 ��2�֣� ��b ��1�֣���3��b��1�֣�
��������
�����������1��H2SO4�ڳ����£����ȶ����ֽ⣬���dz�ʶ������a�Ǵ���ģ���Ӧ����SO2�ǻ�ԭ����HI�ǻ�ԭ�����˻�ԭ��SO2��HI������b����ȷ������͢�ֱ����2�͢���ӵã�2H2O==2H2+O2������c��ȷ��d�Ǵ���ģ���ѡc��
��2������Ϊ �� (H2)=0. 1mol/1L/2min=0.05 mol��L-1��min-1�����Ը��ݷ�Ӧ����֮������Ӧ�Ļ�ѧ������֮�ȿ�֪���� (HI)=2 �� (H2)=0.1 mol��L-1��min-1��
�� 2HI(g)==H2(g)+I2(g)
2 1 1
��ʼŨ��/mol��L��1 1 0 0
�仯Ũ��/mol��L��1�� 0.2 0.1 0.1
ƽ��Ũ��/mol��L��1�� 0.8 0.1 0.1
���Ըÿ��淴Ӧ��ƽ�ⳣ��K=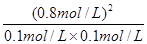 =64mol/L��
=64mol/L��
�������ʼʱ����HI������������2����������ƽ��״̬��ԭƽ��״̬����ǵȱ��ƻ������HI��H2��I2�����ʵ�����ƽ��Ũ�ȶ���ԭ����������������ֵİٷֺ��������������ƽ�ⳣ�����Dz���ġ����ڿ�ʼʱ��Ũ�������ˣ���Ӧ���ʼӿ죬��ƽ���ʱ�䲻������ԭ�������������Դ�ѡb��
��3��ˮ��������ʣ����ڵ���ƽ��H2O=H����OH�������������������Ӷ�ˮ�ĵ������������ã���п�����������Ӻ�������Ũ�Ƚ��ͣ��ٽ�ˮ�ĵ��룻������������ƣ�����Һϴ�൱����������Һ����ʱ����������������������������ƻ�������ӷ�Ӧ������������Ũ�ȣ���Ӧ���ʽ��ͣ������Ƶļ���Է�Ӧ��������Ӱ��ģ���������ͭ��п���û�����Cu����ԭ��أ��ӿ��˷�Ӧ���ʣ����Դ�ѡb��
���㣺���黯ѧ��Ӧ���ʺͻ�ѧƽ����ƶ���Ӱ��ˮ�ĵ�������صȡ�
������������2010��ɽ����28�⣬���������濼���ˡ��ܹ���ʵ������ֽ⣬ͨ���������֪ʶ�����÷������ۺϵķ��������ѧ����������������ܹ��������������Ĺ��̺ͳɹ�����ȷ�Ļ�ѧ���P���֡�ͼ����ģ�͡�ͼ�εȱ�����������͵������������������˿����Ƚ�İ�����龰����������ѭ���ֽ�ˮ���⡱���Կ�������������Ҫ��ϸߡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��2010?ɽ������һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ�� H2+I2
H2+I2 2HI��g����ƽ�ⳣ��K=
2HI��g����ƽ�ⳣ��K=�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
��һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��8�֣���һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2+2H2O+I2===H2SO4+2HI
�� 2HIH2+I2
�� 2H2SO4===2SO2��+O2��+2H2O
(1)����������Ӧ�������ж���ȷ���� ��
a.��Ӧ�����ڳ����½���
b.��Ӧ����SO2�����Ա�HIǿ
c.ѭ���������貹��H2O
d.ѭ�������в���1mol O2��ͬʱ����1mol H2
(2)һ���¶��£���1L�ܱ������м���1mol HI��g��
������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��
0��2 min�ڵ�ƽ����Ӧ����v(HI)= ��
���¶��£�H2(g)+I2(g) 2HI(g)��ƽ�ⳣ��K= ��
��ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������ ��ԭ����2����
a.ƽ�ⳣ�� b.HI��ƽ��Ũ�� c.�ﵽƽ���ʱ�� d.ƽ��ʱH2���������
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ�� �ƶ�����������ҡ����ߡ������������������������Լ��е� ������H2�����ʽ�����
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
��4����H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�ء�
��֪ 2H2(g)+O2(g)===2H2O(l) ��H=-572KJ.mol-1
ij����ȼ�ϵ���ͷ�228.8KJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ɽ��ʡ�ൺ�г�����������ѧ��ѧ���϶����Ի�ѧ�Ծ��������棩 ���ͣ������
��һ��ѭ���ֽ�ˮ�������Ҫ��Ӧ���£�

��1������ѭ����Ӧ���ܷ�Ӧ���Ա�ʾΪ____________________����Ӧ������������õ�������__________��ѡ���ţ���
a�� ???????? b��
???????? b�� ???????? c��
???????? c�� ????? d��HI
????? d��HI
��2��һ���¶��£���2L�ܱ������м���1molHI��g����������ӦII�� �����ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ����
�����ʵ�����ʱ��ı仯��ͼ��ʾ��0~2min�ڵ�ƽ����Ӧ���� _________��
_________��

��3���Է�ӦII������ͬ�¶Ⱥ�����£�����ʼ�����HI(g)�����ʵ�����ԭ����2����������_________Ҳ��ԭ����2����ѡ���ţ���
a��ƽ�ⳣ��??????????? b��HI��ƽ��Ũ��
c���ﵽƽ��ʱ��???????? d��ƽ��ʱ ���������
���������
��4��ʵ������п��ϡ���ᷴӦ��ȡ ����Ӧʱ��Һ��ˮ�ĵ���ƽ��______�ƶ���ѡ�����������������������������������������������Լ��е�_____��ѡ���ţ�������
����Ӧʱ��Һ��ˮ�ĵ���ƽ��______�ƶ���ѡ�����������������������������������������������Լ��е�_____��ѡ���ţ������� �����ʽ�����
�����ʽ�����
a�� ????? b��
????? b�� ????? c��
????? c�� ????? d��
????? d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��Ƚ���ʡ��ѧ�ڸ�����ĩ���Ի�ѧ�Ծ� ���ͣ������
��8�֣���һ��ѭ���ֽ�ˮ������Ҫ�漰���з�Ӧ��
�� SO2+2H2O+I2===H2SO4+2HI
�� 2HI H2+I2
H2+I2
�� 2H2SO4===2SO2��+O2��+2H2O
(1)����������Ӧ�������ж���ȷ���� ��
a.��Ӧ�����ڳ����½���
b.��Ӧ����SO2�����Ա�HIǿ
c.ѭ���������貹��H2O
d.ѭ�������в���1mol O2��ͬʱ����1mol H2
(2)һ���¶��£���1L�ܱ������м���1mol HI��g��
������Ӧ��H2���ʵ�����ʱ��ı仯��ͼ��ʾ��

0��2 min�ڵ�ƽ����Ӧ����v(HI)= ��
���¶��£�H2(g)+I2(g)  2HI(g)��ƽ�ⳣ��K= ��
2HI(g)��ƽ�ⳣ��K= ��
��ͬ�¶��£�����ʼ����HI��g�������ʵ�����ԭ����2������ ��ԭ����2����
a.ƽ�ⳣ�� b.HI��ƽ��Ũ�� c.�ﵽƽ���ʱ�� d.ƽ��ʱH2���������
��3��ʵ������Zn��ϡ������ȡH2����Ӧʱ��Һ��ˮ�ĵ���ƽ�� �ƶ�����������ҡ����ߡ������������������������Լ��е� ������H2�����ʽ�����
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
��4����H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�ء�
��֪ 2H2(g)+O2(g)===2H2O(l) ��H=-572KJ.mol-1
ij����ȼ�ϵ���ͷ�228.8KJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com