
 将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )
将一定质量的钠、钾分别投入到盛有相同浓度和体积的盐酸的两个烧杯中,产生的气体随时间变化曲线如图所示,则下列说法正确的是( )| A. | 投入的Na、K的质量一定相等 | |
| B. | 投入的Na的质量小于K的质量 | |
| C. | 曲线A表示Na与盐酸反应,曲线B表示K与盐酸反应 | |
| D. | 该实验能证明K的金属性小于Na的金属性 |
分析 从所给出的图象可知,钠、钾与分别与盐酸反应生成氢气的质量相等,两金属的物质的量相同;钾活泼性强于钠,所以K与氢离子反应剧烈、速率大,故生成等质量氢气所需时间短,据此分析解答.
解答 解:A.由图可知,二者生成氢气的质量相等,钠、钾都是碱金属,与酸反应都生成+1价阳离子,所以参加反应的两金属的物质的量相同,钾的摩尔质量大于钠,所以需钾的质量要大,故A错误;
B.产生相同量的氢气,消耗钠、钾的物质的量相同,钾的摩尔质量大于钠,所以需钾的质量要大,故B正确;
C.钾活泼性强于钠,所以K与氢离子反应剧烈、速率大,故生成等质量氢气所需时间短,故C错误;
D.该实验能证明K的金属性大于Na的金属性,故D错误;
故选:B.
点评 本题考查了金属的化学性质,明确图象含义、金属活动顺序及有关计算是解题关键,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物中都存在同分异构现象 | |
| B. | 只要含有的官能团种类相同就是同系物 | |
| C. | 14C和14Si是同位素 | |
| D. | C2H5Cl没有同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m+n<p | B. | 平衡向正反应方向移动 | ||
| C. | m+n>p | D. | C的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
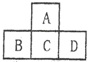 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
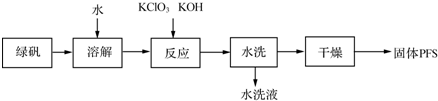
| 方法 | 双氧水氧化法 | 次氯酸钠氧化法 | 硝酸氧化法 |
| 原料 | 绿矾、硫酸、双氧水 | 绿矾、硫酸、次氯酸钠 | 绿矾、硫酸、浓硝酸等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com