
| A. | SiO2既可与NaOH溶液反应也可与HF溶液反应,所以SiO2属于两性氧化物 | |
| B. | SO2溶于水后,其水溶液可以导电,所以SO2属于电解质 | |
| C. | 当光束照射云、烟、雾时,均可看到明显的光路,是因为三者都属于胶体 | |
| D. | 14CO2和12CO2具有相同的元素组成,所以14CO2、12CO2属于同素异形体 |
分析 A.两性氧化物是指与酸和碱都能发生反应且生成物只有盐和水的氧化物;
B.电解质必须是本身能够电离的化合物;
C.云、雾、烟是气体或固体颗粒分散在空气中形成的胶体分散系;
D.同素异形体研究对象是单质.
解答 解:A.二氧化硅与氢氟酸反应得到产物不是盐和水,不是两性氧化物,故A错误;
B.SO2溶于水后生成电解质亚硫酸,亚硫酸电离产生自由离子所以导电,但是二氧化硫本身不能电离,属于非电解质,故B错误;
C.云、雾、烟是气体或固体颗粒分散在空气中形成的胶体分散系,故C正确;
D.14CO2和12CO2都是化合物,不是单质,不属于同素异形体,故D错误;
故选:C.
点评 本题考查了化学概念,熟悉两性氧化物、电解质、胶体、同素异形体的概念是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 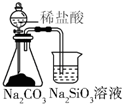 用此图可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 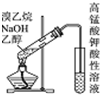 用此图检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| C. |  根据此图装置中U型管液面现象,证明装置漏气 | |
| D. | 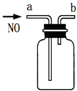 用此图装置收集一瓶纯净的NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
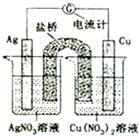 如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )
如图所示原电池的总反应为Cu(s)+2Ag+?Cu2+(aq)+2Ag(s) (盐桥中含有琼脂+饱和KNO3溶液,烧杯中的两溶液均为不饱和溶液),下列叙述正确的是( )| A. | 电子从铜电极经导线和盐桥流向银电极 | |
| B. | 电池工作时,K+向铜极的烧杯移动 | |
| C. | 工作一段时间后,右烧杯中溶液的pH变小 | |
| D. | 将AgNO3溶液更换为Fe(NO3)2溶液,电流计指针反向偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
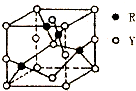 X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:
X、Y、Z、R为前四周期元素,原子序数依次增大.X、Y同周期,X基态原子的最外层电子数是次外层的2倍,Y基态原子的s能级和p能级上电子数相等;Z是地壳中含量最高的金属元素; R+离子的3d轨道全充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
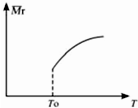 在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g
在温度T0下的2L密闭容器中,加入0.30mol SiC14、0.20mol N2、0.36mol H2进行反应:3SiCl4(g)+2N2(g)+6H2(g)?Si3N4(s)+12HCl(g)2min后达到平衡,测得固体的质量增加了2.80g| 温度T | T1 | T2 | T3 |
| 平衡常数K | 1.2 | 2.5 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X生成的速率与Z分解的速率相等 | |
| B. | 单位时间生成a molX,同时生成3a molY | |
| C. | X、Y、Z的分子数比为1:3:2 | |
| D. | X、Y、Z的浓度不再变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com