
| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 次氯酸的电子式: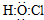 | |
| C. | 氮原子的结构示意图: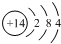 | |
| D. | 碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32- |
分析 A.氯元素的核电荷数为17,中子数为20的氯原子的质量数为37;
B.次氯酸为共价化合物,其中O分别与H和Cl形成一对共价键;
C.氮原子的核外电子总数为7,最外层电子为5;
D.碳酸钠中碳酸氢根不能拆.
解答 解:A.氯元素的质子数为17,中子数为20的氯原子的质量数=17+20=37,该氯原子可以表示为:1737Cl,故A正确;
B.次氯酸中O分别与H和Cl形成一对共价键,且Cl应满足8个电子的稳定结构,正确的为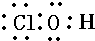 ,故B错误;
,故B错误;
C.氮原子的核电荷数为7,最外层电子为5,总共有2个电子层,正确为 ;故C错误;
;故C错误;
D.碳酸氢钠中碳酸氢根不能拆,正确的NaHCO3=Na++HCO3-,故D错误;
故选:A.
点评 本题考查了电子式、原子结构示意图、结构式、元素符号等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确离子化合物与共价化合物电子式的表示方法及区别.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中只作氧化剂 | |
| B. | 由于Na2O2与H2O反应放出热量和氧气,所以脱脂棉剧烈燃烧 | |
| C. | Na2O2与H2O反应中有氢氧化钠生成,Na2O2是典型的碱性氧化性 | |
| D. | Na2O2与H2O反应中有氧气生成,可用于防毒面具上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
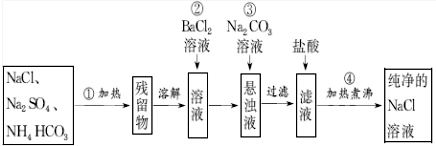
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
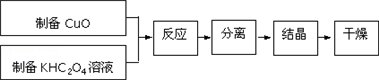
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
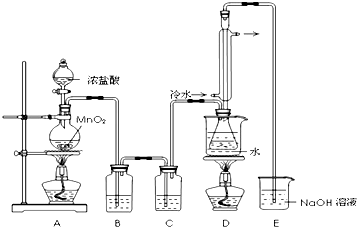
| 物质 | 沸点/℃ | 熔点/℃ |
| S | 445 | 113 |
| CS2 | 47 | -109 |
| CCl4 | 77 | -23 |
| S2Cl2 | 137 | -77 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
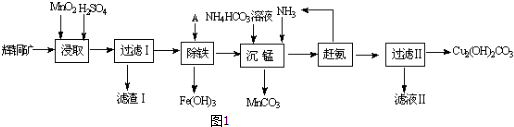
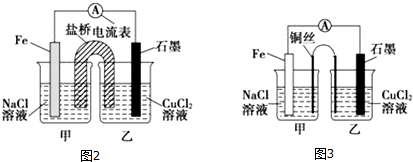
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲的分子数比乙的分子数多 | |
| B. | 甲的物质的量比乙的物质的量小 | |
| C. | 气体摩尔体积:甲<乙 | |
| D. | 甲的相对分子质量比乙的相对分子质量小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com