
下列说法不正确的是
A.钠、钾着火时,不能用泡沫灭火器灭火
B.氧化铝是冶炼金属铝的原料,也是较好的耐火材料
C.石英是制造光导纤维的原料,也是常用的半导体材料
D.在汽车尾气系统中装催化转化器,可降低尾气中CO、NOx等的排放量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年辽宁葫芦岛高级中学高二上期中化学卷(解析版) 题型:选择题
下列实验操作不正确的是
A. 将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,反复多次,完成乙醇氧化为乙醛的实验
B. 实验室制取乙炔时,用饱和食盐水代替蒸馏水,以得到平稳的气流
C. 向试管中先加入无水乙醇,再加入适量冰醋酸与一定量浓硫配制的混酸,然后加热制取乙酸乙酯
D. 验证蔗糖水解产物时,将反应后的溶液与银氨溶液混合水浴加热,观察现象
查看答案和解析>>
科目:高中化学 来源:2017届湖南省益阳市高三上9月调研化学试卷(解析版) 题型:选择题
下列根据实验操作和现 象所得出的结论正确的是( )
象所得出的结论正确的是( )
实验操作 | 实验现象 | 结论 | |
A | 淀粉与稀H2SO4共热,再加银氨溶液水浴加热 | 无银镜生成 | 淀粉水解产物无还原性 |
B | 向某溶液中先滴加氯水,再滴加少量KSCN溶液 | 溶液变成血红色 | 溶液中含有Fe2+ |
C | 将铜粉加入到1.0 mol/L Fe2(SO4)3溶液中 | 溶液变蓝,有黑色固体出现 | 证明金属铁比铜 |
D | 将CO2通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明H2CO3酸性比H2SiO3强 |
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
已知: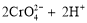

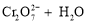 。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(
。25℃时,调节初始浓度为1.0 mol•L-1 的Na2CrO4溶液的pH,测定平衡时溶液中c(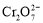 )和c(H+),获得如右图所示的曲线。下列说法不正确的是
)和c(H+),获得如右图所示的曲线。下列说法不正确的是
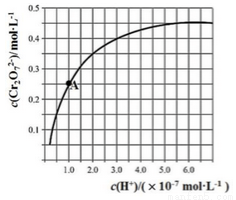
A.平衡时,pH越小,c(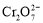 )越大
)越大
B.A点CrO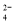 的平衡转化率为50%
的平衡转化率为50%
C.A点CrO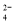 转化为
转化为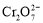 反应的平衡常数K=1014
反应的平衡常数K=1014
D.平衡时,若溶液中c(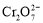 )=c(
)=c(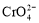 ),则c(H+) > 2.0×10-7 mol·L-1
),则c(H+) > 2.0×10-7 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2017届北京市海淀区高三上学期期中化学试卷(解析版) 题型:选择题
下列解释事实的方程式正确的是
A.用氯化钠溶液做导电实验,灯泡发光:NaCl Na++Cl-
Na++Cl-
B.氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+==Fe3++3H2O
C.石灰水表面漂着的“白膜”可用醋酸溶【解析】
CaCO3+2H+==Ca2++H2O+CO2↑
D.向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42-+Ba2++2OH-==BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:填空题
研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式: 。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
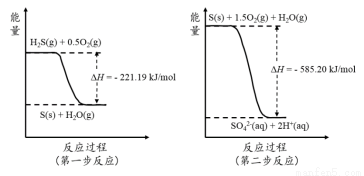
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为 。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:
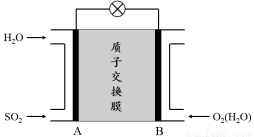
① 质子的流动方向为 (“从A到B”或“从B到A”)。
② 负极的电极反应式为 。
(4)燃煤烟气的脱硫减排是减少大气中含硫化合物污染的关键。SO2烟气脱除的一种工业流程如下:
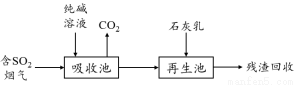
用纯碱溶液吸收SO2将其转化为HSO3-,反应的离子方程式是 。
若石灰乳过量,将其产物再排回吸收池,其中可用于吸收SO2的物质的化学式是 。
查看答案和解析>>
科目:高中化学 来源:2017届北京市高三上学期期中化学试卷(解析版) 题型:选择题
已知:①2C(s)+O2(g)=2CO(g)ΔH=-220kJ·mol-1
②氢气燃烧的能量变化示意图:
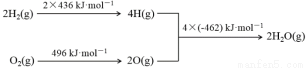
下列说法正确的是
A.1molC(s)完全燃烧放出110kJ的热量
B.C(s)+H2O(g)===CO(g)+H2(g)ΔH=+130kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(g)ΔH=-480kJ·mol-1
D.欲分解2molH2O(l),至少需要提供4×462kJ的热量
查看答案和解析>>
科目:高中化学 来源:2017届西藏林芝一中高三上学期月考一化学试卷(解析版) 题型:选择题
下列物质中的杂质(括号内的物质)除去时,所使用的试剂和主要操作都正确的是( )
选项 | 物质 | 使用的试剂 | 主要操作 |
A | 乙醇(水) | 金属钠 | 过滤 |
B | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
C | 苯(苯酚) | 浓溴水 | 振荡、分液 |
D | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:实验题
PbO2及2PbCO3·Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料。
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到。
①Pb(NO3)2被氧化为PbO2的离子方程式为 。
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)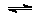 PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K= [已知:Ksp(PbS)= 3.55×10-28;H2S电离常数Ka1=1.3×10-7,Ka2=7.1×10-15 ]。
(2)制备碱式碳酸铅的实验步骤如下:
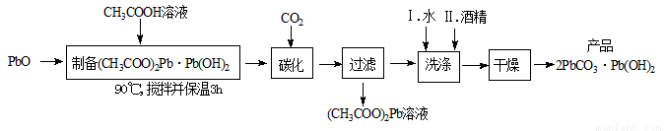
①“碳化”时,发生反应的化学方程式为 。
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 。
(3)为确定2PbCO3·Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如下图所示。
①A→B过程中,从体系中逸出的分解产物(化合物)为 (填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为 (填化学式)。
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com