
科目:高中化学 来源:不详 题型:填空题
 图所示:
图所示: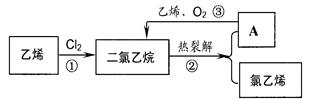
| A.都能在氧气中燃烧 | B.都能发生加成反应。使溴水褪色 |
| C.都能使得酸性高锰酸钾褪色 | D.氯乙烯分子中所有原子共平面 |
 _____________________________________
_____________________________________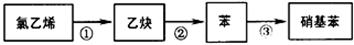
 ______________________________
______________________________查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HBr+NaHSO4 ①
HBr+NaHSO4 ① R-Br+H2O ②
R-Br+H2O ②| | 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
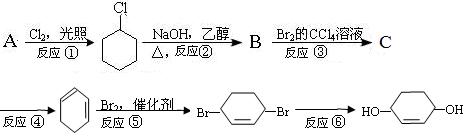


 (1)B的键线式 ,C的结构简式 。
(1)B的键线式 ,C的结构简式 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.⑤④①⑥②③ | B.⑤②①⑥④③ | C.⑤③②① | D.⑤③② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com