
配制250ml 1.0 mol/L 的Na2CO3溶液,需称取Na2CO3固体多少克?取配制好的溶液25ml,往其中逐滴滴加1.0 mol/L的H2SO4溶液15ml,求生成的气体在标准状况下的体积是多少升?
26.5g, 0.005mol,0.112L
解析试题分析:n(Na2CO3)=250ml*10-3L/ml*1.0mol/L=0.25mol; m(Na2CO3)=nM=0.25mol*106g/mol =26.5g;n(H+)=2n(H2SO4)=2*15ml*10-3L/ml*1.0mol/L=0.03mol
CO32- + H+ = HCO3-
1 1 1
0.025mol 0.025mol 0.025mol
HCO3- + H+ = H2O + CO2
1 1 1
0.30-0.025 n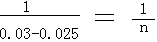 n = 0.005mol
n = 0.005mol
V(CO2)=n*Vm=0.005mol*22.4L/mol =0.112L
考点:本题考查物质的量浓度溶液配制的计算和碳酸钠和酸反应的与量有关的相关计算。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:填空题
在300 mL2mol/LH2SO4溶液中,溶质的质量是 ,此溶液中含H+的物质的量是 ,H+的物质的量浓度是 ,其中含有 个SO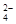 ,SO
,SO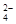 的物质的量浓度是 。
的物质的量浓度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某草酸盐晶体KxFey(C2O4)z?wH2O中铁为+3价,草酸根为-2价,且知x+y+z=7。取该晶体做了以下实验:
① 取4.910g晶体在不同温度下加热至恒重,所得固体的化学式和质量如下表:
| | 120℃ | 300℃ | 480℃ |
| 化学式 | KxFey(C2O4)z | KxFeyO(C2O4)z-1 | KxFeyO2(C2O4)z-2 |
| 质量 | 4.370g | 3.650g | 2.930 g |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点。某研究小组先将某废水中Fe2+氧化为Fe3+,再加入Na2SO4使其生成黄钠铁矾而除去。该小组为测定黄钠铁矾的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后得沉淀1.165 g。
(1)该小组不采用生成Fe(OH)3沉淀的方法除去铁元素,是因为生成的Fe(OH)3 。
(2)用Na2S2O3溶液进行滴定时,使用的指示剂为 ,滴定到终点的颜色变化为 。
(3)通过计算确定黄钠铁矾的化学式(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将50.0g含有NH4NO3、(NH4)2SO4及其它难溶物的混合物样品,溶于水,过滤后加入足量浓NaOH溶液共热,在标准状况下收集到13.44 L氨气,再向溶液中加入足量BaCl2溶液,产生沉淀46.6g,试计算混合物中NH4NO3的物质的量及(NH4)2SO4的质量分数。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
将0.1 mol的镁和铝的混合物溶于50 mL 4 mol·L-1 H2SO4溶液中,然后再滴加2 mol·L-1的NaOH溶液。请回答下列问题:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=80 mL时,计算金属粉末中镁的物质的量及V2的体积。
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,计算滴入NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
① Na2SO4+ 4C→ Na2S+ 4CO↑ ② Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
已知反应:SO2+Cl2+2H2O=2HCl+H2SO4,若反应过程中消耗SO2标准状况下2.24L,
则:(1)求转移电子的数目。
(2)反应后溶液中H+的物质的量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物。甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量。
甲组同学取了数分相同质量的样品A溶于水,然后分别加入不同体积的1mol/L的NaOH溶液,水浴加热至气体全部逸出。(此温度下,铵盐不分解)。该气体干燥后用足量的浓硫酸完全吸收。浓硫酸增重的质量与加入NaOH溶液的体积的关系如图。分析该图像,并回答下列问题: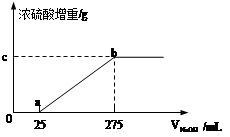
(1)写出ab段涉及的离子方程式: 。
(2)c点对应的数值是 ;样品A中(NH4)2SO4、NH4HSO4的物质的量之比为 。乙组同学取了数份不同质量的样品B,分别加入到200mL 1mol/L的NaOH溶液中,同样用水浴加热,将逸出气体干燥后再用浓H2SO4吸收。测定结果如下表:
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com